|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
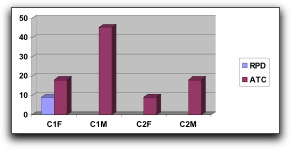
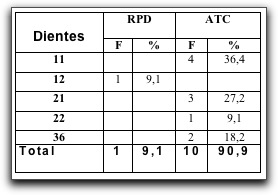
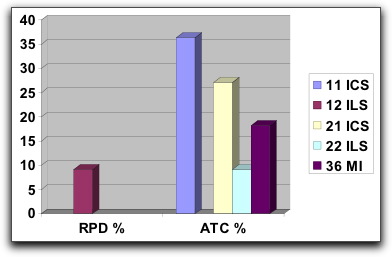
Invitado # 46 : (Enero 2006) " Terapias Endodónticas Empledadas en Dientes Permanentes Incompletamente Formados Realizadas en el Postgrado de Endodoncia de la Universidad Central de Venezuela en el Período Enero 2002 - Abril 2005 " por María Eugenia Rojas Odontólogo, Universidad del Zulia, 2001 Especialista en Endodoncia, Universidad Central de Venezuela, 2005 e-mail: marujae@yahoo.com
Introducción Una vez que el diente erupciona en la cavidad bucal, lo hace con una formación radicular incompleta por lo que se denomina diente inmaduro o con ápice abierto. La patología pulpar como secuela de caries o de lesión traumática puede interferir en la vitalidad pulpar, lo que conlleva a una interrupción de la formación normal de la raíz creando un problema en diversas áreas de la odontología, específicamente en endodoncia. La pulpa es necesaria para la formación de dentina. La pérdida de la vitalidad pulpar en un diente permanente juvenil antes de concluir la formación radicular trae como consecuencia una raíz de paredes delgadas y propensas a la fractura. En estos casos, la forma del conducto y sus dimensiones dificultan mucho los procedimientos endodónticos convencionales, necesarios debido a que su foramen abierto no proporciona una barrera anatómica de la raíz y es muy difícil mantener el tratamiento endodóntico dentro de los limites del conducto; sobre todo se hace imposible obturarlo de manera tridimensional. Por ello, se deben realizar todos los esfuerzos necesarios para mantener la vitalidad pulpar de los dientes incompletamente formados para lograr su completo desarrollo radicular. El recubrimiento pulpar indirecto, el recubrimiento directo y la pulpotomía son habitualmente convenientes en estos dientes; porque ellos reciben un aporte sanguíneo excelente a través del ápice abierto. Sin embargo, cuando el tejido pulpar se necrosa o se desarrolla una patología periapical, el tratamiento de elección en estos dientes es la inducción del cierre apical o apicoformación. El objetivo de este trabajo es determinar la terapia endodóntica empleada con mayor frecuencia en dientes incompletamente formados realizadas en el postgrado de Endodoncia de la Universidad Central de Venezuela en el período de Enero 2002 y Abril 2005.
Desarrollo Dentario Es necesario el conocimiento completo de la formación normal del diente para poder comprender el proceso implicado en el tratamiento de dientes permanentes con ápices inmaduro.(1) El ciclo vital del los órganos dentarios comprende una serie de cambios químicos, morfológicos y funcionales que comienzan en la sexta semana de vida intrauterina y que continúan a lo largo de toda la vida del diente.(2,3) Los dientes se desarrollan a partir de brotes epiteliales que comienzan a formarse en la porción anterior de los maxilares y luego avanzan en dirección posterior.(3) Estos poseen una forma determinada de acuerdo al diente que darán origen y una ubicación estratégica en los maxilares, pero todos tienen un desarrollo común el cual se realiza de forma gradual y paulatina.(3) La formación de los dientes comienza como una proliferación localizada del ectodermo, asociada con los procesos de los maxilares superior o inferior. Esta actividad proliferativa trae como resultado la formación de dos estructuras en forma de herradura, una sobre cada proceso, las cuales son denominadas banda epitelial primaria.(2,4) Simultáneamente, en el ectomesénquima subyacente se origina una condensación de células las cuales inducen a la proliferación del epitelio, formando láminas que lo invaden en profundidad y constituyen las láminas dentales o listón dentario.(2,3,4) A partir de este momento se establece una inducción epitelio mesenquimatosa reciproca que permitirá el desarrollo de las estructuras que se forman del epitelio ectodérmico (esmalte) y del ectomesénquima, como la dentina, pulpa, cemento, ligamento periodontal y hueso alveolar.(2) Trowbridges y Kim(4) describen la formación de los gérmenes dentarios como un proceso continuo que es conveniente dividirlo en tres etapas para establecer distinciones claras entre ellas. De acuerdo a su morfología se denominan: etapa de brote o yema, etapa de casquete o cáliz y etapa de campana. La etapa de brote es la etapa inicial en el desarrollo dentario, en la cual las células epiteliales de la lámina dental proliferan y producen una proyección en forma de "brote" en el ectomesénquima adyacente, el cual se condensa y forma el saco o folículo dentario.(2,3,4) La estructura de los brotes es simple; en la periferia se identifican células cilíndricas y en el interior son de aspecto poligonal con espacios intercelulares muy pequeños. Estos serán los futuros órganos del esmalte que darán lugar al único tejido de naturaleza ectodérmica del diente, el esmalte.(3) La etapa de cáliz o casquete se alcanza cuando las células de la lámina dental han proliferado y permiten una invaginación del ectomesénquima, que constituye la papila dentaria la cual dará origen al complejo dentino- pulpar.(2,3,4) En esta etapa se observa un epitelio periférico externo constituido por células cúbicas que rodean a células epiteliales poligonales en el interior y que constituyen el epitelio externo del esmalte.(2,4)Entre el epitelio externo e interno del órgano del esmalte existe una red de células denominadas retículo estrellado debido a su disposición reticular ramificada de los elementos celulares.(1-4) El margen del órgano del esmalte donde se une el epitelio interno y externo es denominado curva cervical, a medida que las células forman la curva, continua la proliferación del esmalte y se produce una invaginación mas pronunciada del órgano del esmalte en el mesénquima el cual adquiere forma de campana.(4) Durante la etapa de campana, en el epitelio periférico se pueden distinguir dos áreas, una en relación con la papila dental, que es el epitelio interno del esmalte y otra en relación con el saco dentario que es el epitelio externo del esmalte.(2) El epitelio interno del órgano del esmalte se encuentra separado de las capas de células mesenquimatosas indiferenciadas por una membrana denominada membrana basal dental.(4,5)Las células mesenquimatosas de la papila dental emiten prolongaciones largas y delgadas que atraviesan la zona acelular y contactan con las de epitelio interno del esmalte quedando entre ambos tipos una membrana basal.(2) A partir de este momento se establece un proceso de inducción reciproca en el cual la maduración celular se inicia y es más rápida en la capa del epitelio interno del esmalte o preameloblastos, que en la de los predentinoblastos, diferenciándose en primer lugar los ameloblastos que los dentinoblastos.(2,4) Aunque la maduración de las células formadoras de esmalte ocurra primero, éstas no inician su formación hasta que no se haya formado la primera capa de matriz orgánica extracelular de predentina inicial, la cual una vez mineralizada constituye la dentina.(2,4) Una vez que se constituye la primera capa de dentina, los ameloblastos formarán la primera capa de esmalte.(2,3,4)Con la aparición de la dentinogénesis la papila dental se convierte en la pulpa dental.(4)El comienzo de la diferenciación y maduración de los tejidos dentarios comienza en los vértices cuspídeos y bordes incisales de los futuros dientes.(2,4) Los extremos más apicales del epitelio externo e interno del esmalte están en íntimo contacto, no existiendo células del retículo estrellado entre ellos, formando así el ojal cervical.(2,3,4) Todos estos elementos estructurales de la etapa de campana constituyen el órgano del esmalte.
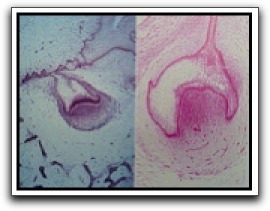
Figura1: Invaginación de la papila dentaria dentro del órgano del esmalte. Tomado de Castellucci, 1993.
El desarrollo de la raíz comienza una vez que se ha completado la formación del esmalte.(5)Las células cilíndricas del epitelio interno del esmalte y las células cúbicas del epitelio externo que conforman la curva cervical, comienzan a proliferar y forman una estructura conocida como la vaina radicular epitelial de Hertwig, responsable de la formación de la raíz dentaria.(5,6)Esta determinara el tamaño, número y forma de las raíces. (2,5,6)Posteriormente, las células de la capa interna inducen la diferenciación de las células del tejido conjuntivo hacia odontoblastos y se deposita la primera capa de dentina.(5) La diferenciación de los odontoblastos y la formación de dentina siguen al alargamiento de la vaina radicular. Al mismo tiempo, el tejido conjuntivo del saco dentario que la rodea, prolifera y divide a la capa epitelial en una malla de bandas continuas.(5) Tan pronto como se mineraliza la primera capa de la matriz de dentina, las células mesenquimáticas del saco dental se mueven hasta hacer contacto con la dentina recién formada(2,4) Estas células se diferencian en cementoblastos y depositan la matriz del cemento en la dentina radicular. (5,6) Cuando la vaina epitelial radicular de Hertwig ha alcanzado su longitud máxima, se dobla hacia dentro en cada lado para formar el diafragma epitelial.(2)Dicha estructura establece la longitud del diente y delimita el foramen apical por el cual entran y salen nervios y vasos sanguíneos de la cámara pulpar.(2)Durante la formación y desarrollo de la vaina epitelial de Hertwig se pueden originar pequeñas interrupciones que dan origen a los conductos laterales o accesorios.(2,5,6) El remanente epitelial no desaparece por completo al comenzar la dentinogénesis. Algunas de estas células permanecen en el ligamento periodontal, conocidas como restos epiteliales de Malassez, los cuales persisten cercanos a la superficie radicular y se presentan como fuente de revestimiento de los quistes periapicales que se forman como reacción a la inflamación crónica de la pulpa o tejidos subyacentes.(5,6)
Clasificación del desarrollo radicular y apical Patterson en 1958 publicó una clasificación muy didáctica de los dientes permanentes según su desarrollo radicular y apical dividiéndolos en las siguientes cinco clases(7):
Patología pulpar y pariapical del diente incompletamente formado Los dientes permanentes jóvenes son aquellos que aún no han completado la formación de sus raíces. Estos presentan una abertura apical mayor que la existente en los dientes maduros.(8) El desarrollo del órgano dentario, no solo depende de la edad cronológica de la misma; las diversas patologías pulpares que pudieran haberla afectado también inciden en la aceleración de su proceso de envejecimiento.(8) En los dientes permanentes jóvenes, la pérdida de la vitalidad pulpar origina problemas especiales, debido que la pulpa dental es necesaria para la formación de la dentina. Su pérdida antes de finalizado el crecimiento longitudinal de la raíz ocasiona una mala relación corona-raíz.(1)El crecimiento se detiene en aquellos casos en los que la pulpa ha sufrido lesiones irreversibles formando como consecuencia una raíz poco desarrollada.(1) La pulpa reacciona frente a cualquier agente patógeno sea físico, químico o bacteriano cuyos estímulos superen el límite de tolerancia fisiológica, aún considerando que este límite puede estar alterado como en los casos de presencia de caries. Ante estos factores imitativos se produce una respuesta inflamatoria o degenerativa, la cual se caracteriza por el aumento de volumen de la pulpa y por consiguiente la compresión de sus elementos estructurales lo que determina la aparición de las alteraciones pulpares.(9) En función de la intensidad y duración de los irritantes y de la resistencia del huésped, la patología pulpar puede variar desde una inflamación temporal o pulpitis reversible, hasta una inflamación grave y progresiva o pulpitis irreversible que evolucionará hacia la necrosis.(10) La caries y los traumatismos dentarios constituyen las causas mas frecuentes de lesiones pulpares en dientes permanentes jóvenes.(8) Simón(11) et al. afirman que la densidad de células inflamatorias y la intensidad de la lesión pulpar aumenta conforme la caries avanza en profundidad y amplitud. La capacidad de la pulpa para soportar la lesión se relaciona con la gravedad de ésta. Con el avance de la lesión cariosa por la suma de agentes irritantes, incluyendo factores físicos y químicos en razón de mayor exposición de dentina al medio bucal, se presentan las primeras alteraciones vasculares de la pulpa dental, que caracterizan un proceso inflamatorio incipiente en el cual se produce una congestión sanguínea, un estado inflamatorio reactivo, considerándolo como un periodo inicial inflamatorio que representa una señal de alerta, indicando que la resistencia normal de la pulpa esta llegando al límite de tolerancia fisiológica, por lo tanto, esta debe ser considerada como una situación reversible siempre que sea eliminada su causa.(11) Simón (11) et al. definen la pulpitis reversible como la inflamación de la pulpa con capacidad reparativa; es la primera respuesta inflamatoria pulpar frente a diversos irritantes. La pulpa está inflamada hasta el punto de que estímulos térmicos, habitualmente el frío, causa una respuesta de hipersensibilidad rápida, aguda que cesa tan pronto desaparece el estímulo; la lesión es de predominio crónico y la inflamación se circunscribe a la base de los túbulos afectados.(11) Simón (11) et al. señalan que si el irritante es eliminado y además se evitan nuevas agresiones mediante el sellado de los túbulos de la dentina que comunican con la pulpa inflamada, ésta recupera un estado asintomático sin inflamación. Por el contrario si éste persiste los síntomas se pueden prolongar por un tiempo indefinido o hacerse más extensa y conducir a una pulpitis irreversible. La penetración franca de bacterias en la pulpa suele ser el punto crucial para la pulpitis irreversible. Esto no significa que ésta no pueda ocurrir antes de la exposición. Las bacterias son los principales agentes implicados en la aparición de esta alteración pulpar.(3) La pulpitis irreversible es la inflamación de la pulpa sin capacidad de recuperación, a pesar de que cesen los estímulos externos que han provocado el estado inflamatorio.(10) La pulpa no cicatrizará y poco a poco degenerará y ocasionará necrosis destrucción reactiva.(12) La pulpitis irreversible puede ser aguda, subaguda o crónica; puede tener carácter parcial o total y acompañarse de infección o ser estéril.(11) Desde el punto de vista clínico, la pulpa con inflamación aguda es sintomática, mientras que la pulpa con inflamación crónica es asintomática en la mayoría de los casos. La extensión apical de la pulpitis irreversible no se puede determinar clínicamente, hasta que el ligamento periodontal se afecta por la cascada de mediadores inflamatorios, cuya consecuencia clínica suele ser que el diente presenta sensibilidad a la percusión.(11) Una variante de la pulpitis irreversible asintomática es el crecimiento del tejido pulpar, de color rojizo y en forma de coliflor, alrededor de una exposición cariosa. La naturaleza proliferativa de este tipo es atribuida a una irritación crónica de bajo grado denominada pulpitis crónica hiperplàsica y a una generosa vascularización hallada de forma característica en individuos jóvenes. En ocasiones, esta situación puede causar dolor transitorio y ligero durante la masticación.(11) Las pulpitis agudas y crónicas, así como los estados degenerativos, de acuerdo con las condiciones intrínsecas pulpares y la intensidad del agente agresor, podrán evolucionar, lenta o rápidamente, hacia la muerte pulpar, lo que significa la cesación de los procesos metabólicos de este órgano con la consiguiente pérdida de su vitalidad, de su estructura, así como de sus defensas naturales.(9) La necrosis pulpar es la descomposición, séptica o no, del tejido conjuntivo pulpar que cursa con la destrucción del sistema microvascular y linfático, de las células y, en última instancia de las fibras nerviosas. (10) Simón(11) et al. describen la necrosis pulpar como una condición histológica originada por una pulpitis irreversible no tratada, una lesión traumática o cualquier circunstancia que origine la interrupción prolongada del suministro sanguíneo de la pulpa. La necrosis pulpar puede ser parcial o total, la necrosis total es asintomática antes de llegar a afectar el ligamento periodontal, puesto que los nervios de la pulpa carecen de función. Ingle(12) señala que dada la falta de circulación colateral y la rigidez de las paredes de la dentina, hay un drenaje insuficiente de los líquidos inflamatorios, lo que ocasiona alzas circunscritas en las presiones en los tejidos , y da lugar a destrucción progresiva e inadvertida, hasta que la pulpa se necrosa. Las pulpas de dientes en los cuales las células pulpares murieron como resultado de coagulación o licuefacción se clasifican como necróticas.(6) La región de necrosis contiene irritantes provenientes de la destrucción de los tejidos y microorganismos tanto aerobios y anaerobios. Estos factores irritantes establecen contacto con el tejido vital periférico y continúan ejerciendo daño(13), las bacterias penetran hasta los límites de la necrosis pero no se observan en el tejido inflamado adyacente. Sin embargo, en todo momento las toxinas y enzimas bacterianas penetran a los tejidos circundantes y estimulan la inflamación.(14) La inflamación perirradicular tal vez no se desarrolle, sino hasta que la pulpa este casi completamente necrótica, sin embargo a veces hay pulpa vital inflamada y pulpa radicular histológicamente normal con signos radiográficos de inflamación perirradicular.(11) Sin embargo, aunque no se ha demostrado en condiciones experimentales, los factores irritantes deben difundirse desde los tejidos coronales, pasar a través de la pulpa radicular, y desencadenar una respuesta inflamatoria perirradicular con resorción reactiva. Esta entidad clínica suele observarse en niños, adolescentes o adultos jóvenes y pueden plantear problemas diagnósticos.(11) La inflamación periapical de origen pulpar se debe a la llegada de toxinas bacterianas e incluso bacterias al periodonto a través del orificio apical. De igual forma puede suceder en otras zonas del periodonto, a través de un conducto lateral y en la zona de la bifurcación, a través de comunicaciones frecuentes entre el suelo de la cámara pulpar y el periodonto.(10,11) Cuando la cascada de irritantes sale del conducto radicular muchas veces se produce enfermedad periapical.(15) El periápice del diente se involucra cuando las bacterias invaden la pulpa, produciendo necrosis parcial o total, así se demostró con el estudio clásico de Kakehashi(16) et al. en ratas gnotobióticas (libres de gérmenes), en el cual se expusieron las pulpas de ratas normales y las dejaron abiertas al medio bucal. Se produjo necrosis pulpar, seguida de inflamación periapical y la formación de una lesión en la zona. Sin embargo, cuando se realizó ese mismo procedimiento en ratas libres de gérmenes, las pulpas no sólo permanecieron vitales y sin apenas inflamación, sino que los orificios dejados por la fresa se repararon a los 36 días. El estudió demostró que sin bacterias y sus productos, las lesiones apicales de origen endodónticos no se producen. La inflamación periapical puede empezar antes de que la pulpa esté totalmente necrótica. Esto puede explicar la posible presencia de radiolucencia periapical, existiendo todavía algún tejido vital remanente en el conducto radicular.(10,11) Simón (11) et al. afirman que la patología periapical es el resultado de las bacterias, sus productos y la respuesta del huésped a los mismos; dentro de las cuales tenemos: la periodontitis apical aguda, absceso apical agudo, periodontitis apical crónica. La periodontitis apical aguda es un proceso inflamatorio agudo alrededor del ápice (periodontitis). Esta situación puede confundir el resultado de la extensión de la inflamación de la pulpa en el tejido periapical, el traumatismo mecánico o químico causado por instrumentos o materiales endodónticos o el traumatismo de las superficies oclusales provocado por hiperoclusión o bruxismo, ya que ésta puede ocurrir en dientes con y sin vitalidad pulpar.(11) Cuando la pulpa ha experimentado necrosis y no se trata de una periodontitis apical aguda, pueden aparecer síntomas conforme la enfermedad avanza hacia la siguiente fase el absceso perirradicular agudo.(10,11) Simón (11) et al. afirman que puede producirse un absceso apical agudo cuando un gran número de bacterias pasan al ápice y provocan una respuesta inflamatoria grave. El absceso se define como una colección de pus localizada, microscópicamente compuesta por células muertas, detritos, polimorfonucleares y macrófagos. Clínicamente los grados de inflamación son, con o sin dolor, son variables. La periodontitis apical crónica es una respuesta mantenida en el tiempo y de relativo o de bajo grado debido a las bacterias del conducto y a los irritantes. Clínicamente, esta lesión suele ser asintomática y se detecta con radiolucencia apical.(11)Esta lesión se caracteriza por el predominio de linfocitos, células plasmáticas y macrófagos rodeados por una cápsula fibrosa apenas inflamada compuesta por colágeno, fibroblastos y brotes capilares.(10) Diagnóstico pulpar de los dientes incompletamente formados Un diente incompletamente formado puede necesitar una terapia endodóntica por diversas razones, presentando patologías pulpares como consecuencia de un traumatismo, una lesión de caries, un tratamiento ortodóntico, o una exposición pulpar mecánica.(17) El diagnóstico de una enfermedad pulpar es muy difícil en los pacientes jóvenes porque con frecuencia no pueden explicar con precisión sus síntomas.(17)Esto suele ser más difícil de precisar en los dientes con ápices abiertos, ya sea por la dificultad del niño en manifestar lo que siente o por la correlación de los síntomas clínicos. Por ello, se deben extremar los detalles para poder llegar a una información más precisa.(2) La necesidad de ejecución de procedimientos distintos para los dientes con pulpa viva y pulpa necrótica exige un diagnóstico preciso de su estado.(17) Por su parte, Camp(1) et al. señalan que no existen unas pruebas diagnósticas clínicas confiables para evaluar con precisión el estado de una pulpa dental inflamada. Para realizar el diagnóstico más exacto, se debe obtener información a partir de diversas fuentes, entre ellas, una historia clínica cuidadosa, características del dolor, exámenes clínicos y radiográficos completos.(18,19) En la anamnesis se encuentran antecedentes de traumatismos (golpes, caídas, prácticas deportivas). Sobre alguno de los dientes con la pulpa expuesta en la mayoría de los casos; se debe preguntar por el tiempo transcurrido desde el traumatismo y evaluar, en lo posible, el impacto recibido.(19) También se debe prestar especial atención sobre las características del dolor, si esta presente, si lo hubo, el factor desencadenante, duración, intensidad, irradiación y si ha necesitado de medicación para el alivio del dolor.(17,19)El síntoma principal y la historia de dolor son factores importantes a considerar a la hora de establecer un diagnóstico.(18) Una exploración extraoral e intraoral cuidadosa puede ser importante para detectar la presencia de alteraciones pulpares en un diente.(18) Se debe examinar cada diente los tejidos de soporte y los tejidos blandos, debido a que existen diversos signos tales como: enrojecimiento, tumefacción del vestíbulo, fístulas, fracturas dentales, restauraciones defectuosas, caries, pigmentación de la corona; los cuales pueden ser indicadores de patologías pulpares presentes.(2) Basrani(8) et al. señalan que se deben evaluar con detenimiento las cavidades cariosas, el estado del piso de la misma (duro o blando), profundidad, la presencia de fisuras o de fracturas y su extensión, hipoplasia u otro tipo de alteraciones. A su vez, se debe evaluar los cambios de color de la pieza dentaria (rosados, pardos, grisáceos o blanquecinos) que evidencian hemorragias pulpar, necrosis o descalcificaciones adamantinas por caries. La palpación, la valoración de la movilidad dentaria, y de la sensibilidad a la percusión son medios diagnósticos útiles para el diagnóstico de patologías pulpares.(2) Camp(20) et al. afirman que por lo general, los dientes con inflamación pulpar conllevan a la presencia de dolor a la percusión, el cual puede poner de manifiesto que dicha inflamación ha progresado hasta afectar el ligamento periodontal. Sin embargo se debe tener cuidado en la interpretación de esta prueba. Bellanger sugiere que la prueba de la percusión se debe realizar con suavidad, se prefiere la presión digital que el golpear con el mango de un espejo para producir dolor, ya que no es confiable y resulta bastante incómodo para el paciente.(18) Al igual que la prueba de percusión, la palpación permite diagnosticar complicaciones periapicales de la enfermedad pulpar. Mediante el tacto se puede estimar la presencia de zonas abultadas o fluctuantes en el fondo del surco que pueden indicar exacerbación de una lesión. El uso rutinario de este medio de diagnóstico ayuda a evaluar la extensión de la patología periapical existente.(18) Las pruebas pulpares se emplean para estimar la fisiopatología de la pulpa evaluando el grado de respuesta dolorosa ante la aplicación de diferentes estímulos. Una de ellas es la prueba térmica la cual se utiliza en gran medida en dientes con ápices abiertos, pero pueden ser complicadas por la falta de un desarrollo neural o por respuesta exagerada debido a la aprensión.(1) Pitt Ford(17) señala que cuando no hay respuesta a las pruebas térmicas repetidas y ésta es positiva en el diente control contralateral, hay una pulpa necrótica. Esto se puede confirmar con otras pruebas, pero cuando existe el problema de que se presente un diente con ápice abierto causado por una luxación, se produce una alteración en la conducción nerviosa mientras que su irrigación permanece intacto por lo tanto hay ausencia de respuesta pulpar. Por su parte, Basrani(8) et al. afirman que por un trauma importante puede existir una interrupción temporal de la irrigación pulpar y no llega aporte nutricional a las fibras sensitivas A-delta responsables de la conducción del dolor. Estas fibras maduran entre los 4 a 5 años después que el diente entra en erupción; por eso la falta de respuesta pulpar en un principio, no es un indicador de la muerte de la misma. Por lo referido anteriormente en los dientes con ápices inmaduros puede no existir respuesta. El dióxido de carbono debido a su baja temperatura otorga una respuesta segura, aún en este tipo de dientes.(2) De igual forma la prueba eléctrica en los dientes jóvenes con ápices abiertos amplios no es confiable debido a que los nervios sensoriales no están desarrollado. Se debe considerar la etapa de erupción de la pieza dentaria ya que las respuestas de los dientes difieren en las distintas fases. El umbral de excitación disminuye a un grado normal a medida que se completa la erupción.(21) Por tanto, los resultados deben interpretarse con precaución.(1) La exploración clínica deberá ir seguida por una radiografía, la cual constituye uno de los medios que aporta la mayor cantidad de datos para el diagnóstico, pronóstico, tratamiento y los controles a distancia de los dientes permanentes jóvenes.(17) Al examen radiográfico, un diente incompletamente formado debe evidenciar el nivel de desarrollo apical que se caracteriza por presentar el espacio del conducto radicular muy amplio y las paredes radiculares delgadas, lo cual las hace más frágiles.(17) Pitt Ford(17) afirma que normalmente hay un área radiolúcida que rodea al ápice abierto de un diente inmaduro en desarrollo con una pulpa sana. En ocasiones es difícil diferenciarla de una zona radiolúcida patológica debido a una pulpa necrótica. La comparación con el periápice del diente contralateral es de gran ayuda, en especial con los resultados de otras pruebas diagnósticas. Una radiografía convencional proporciona sólo una imagen bidimensional y no revela la tercera dimensión, que es importante en un diente con ápices abiertos, debido a que se puede observar la superficie mesiodistal con el ápice casi cerrado; pero cuando se observa que desde proximal que hay una abertura de mayor tamaño. Estas imágenes pueden conducir a la selección del tratamiento inadecuado. Por esto si se presentan dudas acerca de la anatomía apical, es útil tomar radiografías anguladas.(17) La correcta interpretación radiográfica y la edad del diente, junto con la realización de otras pruebas, contribuirán con el diagnóstico.(2) Prophet et al. han hecho hincapié en que no es posible confiar de ningún medio diagnóstico individual para establecer un diagnóstico de patología pulpar.(22)
Terapia pulpar de dientes incompletamente formados La patología pulpar como secuela de caries o de lesión traumática puede interferir en la formación normal de la raíz y crear un problema especial en endodoncia. Como la pulpa es necesaria para la formación de dentina, la pérdida de vitalidad en un diente permanente juvenil antes de finalizar la formación radicular deja una raíz frágil y débil propensa a la fractura.(18,23,24) Las técnicas endodónticas habituales son insuficientes para obturar los grandes conductos que presentan estos dientes. Aunque se han desarrollado procedimientos para tratar estos dientes, el pronóstico de retención permanente de los mismos es limitado cuando se compara con el diente totalmente desarrollado.(2) Las modalidades de tratamiento actual de dientes inmaduros en los que se ha expuesto la pulpa son conservadoras, y su objetivo principal es mantener la vitalidad de la pulpa radicular para permitir que termine de formarse la raíz.(18,22,25-27) El acierto en la elección y oportunidad del empleo de técnicas endodónticas en piezas permanentes jóvenes constituyen un tema amplio y delicado, debido a que intervienen varios factores en la determinación del tratamiento a efectuar, tales como: el grado de desarrollo radicular y el estado pulpar.(2) Basrani(8) et al. señalan que las afecciones pulpares estimadas como reversibles deben ser tratadas mediante terapias conservadoras. Los estados irreversibles pueden llegar a determinar la utilización de técnicas inductoras, dependiendo del desarrollo radicular. Ante pulpas necróticas siempre se recurre a tratamientos inductores.(28) El recubrimiento pulpar indirecto, el recubrimiento pulpar directo y la pulpotomía son útiles en estos dientes porque reciben un aporte sanguíneo excelente a través del ápice abierto. Si el diente pierde la pulpa o se desarrolla una patología periapical el tratamiento preferido es la apicoformación.(18) Frank señala que el éxito del tratamiento endodóntico en los dientes con ápice inmaduro va ha depender en gran medida de la realización de un buen sellado del conducto radicular, pero conseguir un sellado adecuado en estos dientes es muy complicado, ya que al no existir cierre apical y dada la fragilidad de las paredes, no se puede condensar la gutapercha adecuadamente.(29) Recubrimiento pulpar indirecto El concepto del recubrimiento pulpar indirecto fue descrito inicialmente por Pierre Fauchard según lo informó John Tomes a mediados del siglo XVIII, quien recomendó que no se retirara toda la caries en cavidades sensibles y profundas por "temor a exponer el nervio y que la curación sea peor que la enfermedad".(20) Dummett(22) et al. lo definen como la aplicación de un medicamento sobre una capa delgada de dentina cariosa remanente, después de la excavación profunda sin exposición de la pulpa. Por su parte Camp(20) et al. afirman que es una técnica que pretende evitar la exposición de la pulpa en el tratamiento de dientes con caries profundas y en los que existen signos clínicos de compromiso pulpar . La terapia pulpar indirecta se basa en la teoría de que entre la capa interna infectada y la pulpa, existe una zona de dentina afectada y desmineralizada; al eliminar la dentina infectada, la dentina que se encuentra afectada puede remineralizarse y los odontoblastos forman una dentina de reparación, con lo que se evita la necesidad de exponer la pulpa.(1,30,31) Diversos estudios(32,33) han demostrado que la remineralización fisiológica solo puede ocurrir si la capa interna con caries contiene fibras de colágeno sanas y procesos odontoblásticos vivos. Las fibras de colágeno sanas actúan como base donde se fijarán los cristales de apatita.(34,35)Por su parte los procesos odontoblásticos vivos proporcionan fosfato cálcico para que se produzca una remineralización fisiológica.(36) Camp(20) et al. señalan que este procedimiento permite al diente hacer uso de los mecanismos de protección natural y fisiológica contra la lesión de caries. El objetivo del tratamiento es detener el avance de la lesión de caries favoreciendo una esclerosis de la dentina y estimulando la promoción de una dentina de reparación con remineralización de la dentina afectada por la lesión cariosa preservando la vitalidad de la pulpa dental.(1,15) Whitehead et al. compararon excavaciones profundas en dientes primarios y permanentes, realizando la eliminación de toda la dentina reblandecida del piso de la cavidad y encontraron que un 51,5% de los dientes permanentes estaban libres de todos los signos de microorganismos, y un 34% adicional tenían únicamente de uno a 20 túbulos dentinarios infectados. Sin embargo, los dientes primarios demostraron altos porcentajes de bacterias en el piso de la cavidad después que se retiró la dentina reblandecida.(22) Estos resultados fueron apoyados por Shovelton, quien encontró que si bien las capas desmineralizadas mas profundas de la dentina, generalmente estaban libres de infección, existía la posibilidad de que algunos túbulos dentinarios contuvieran microorganismos, sobre todos en dientes primarios.(22) Por su parte, Seltzer y Bender(6) refieren que la eliminación completa de la dentina cariada no necesariamente garantiza que se hayan erradicado todos los túbulos infectados y viceversa, la existencia de dentina reblandecida no necesariamente indica infección. Diversos investigadores han brindado pruebas de que la pulpa fácilmente puede hacer frente a la contaminación leve. Reeves y Shovelton demostraron que cuando la cercanía de la lesión cariosa a la pulpa era mayor de 0.8 mm. no ocurría un trastorno importante en la pulpa de dientes permanentes.(9,22) Massler consideró que las reacciones pulpares bajo lesiones cariosas profundas obedecían a las toxinas bacterianas mas que a las bacterias en sí.(37) DiMaggio y Hawes seleccionaron dientes temporales y permanentes sin signos clínicos de degeneración pulpar ni enfermedad periapical, en los que radiográficamente parecía probable una exposición pulpar si se eliminaba toda la caries.(22) Realizaron la eliminación de toda la caries y observaron exposición pulpar en un 75% de los dientes, en cambio, en el otro grupo de dientes que clínicamente parecían idénticos a los del primer grupo, evitando las exposiciones de la pulpa mediante la terapia pulpar indirecta, se observó una tasa de éxito de un 99% de los casos. Además, al publicar los resultados observados en un mayor número de dientes con un seguimiento de 2 semanas a 4 años, la terapia pulpar indirecta siguió asociándose a un porcentaje de éxito de un 97%.(22) El tratamiento pulpar indirecto ha demostrado ser una técnica con gran éxito cuando se seleccionan bien los casos. Los porcentajes de éxito observados en publicaciones van desde un 74 hasta un 99%. Las variaciones del porcentaje de éxito se deben a factores como diferencias en la selección de los casos clínicos así como duración y tipo del estudio.(1,22) El tratamiento pulpar indirecto se utiliza cuando la inflamación parece mínima y la eliminación completa de la caries probablemente causaría una exposición de la pulpa. Antes de iniciar el tratamiento debe hacerse un diagnóstico meticuloso del estado de la pulpa dental. Cualquier diente con posible inflamación extensa o signos de enfermedad periapical no es candidato a la terapia pulpar indirecta.(16) Dummett(22) et al. afirman que la selección de los casos basada en la valoración clínica y radiográfica para fundamentar el estado de salud de la pulpa es decisiva para el éxito. Se considerarán para el recubrimiento pulpar indirecto únicamente los dientes que estén libres de signos y síntomas irreversibles. La decisión para llevar a cabo éste procedimiento se basará en los siguientes datos(1): Antecedentes: malestar leve por estímulos químicos y térmicos, sin dolor espontáneo. Examen clínico: lesión cariosa de gran tamaño, aspecto normal de la encía adyacente y diente de color normal. Examen radiográfico: lesión cariosa de gran tamaño muy cerca de la pulpa, lámina dura y espacio del ligamento periodontal normal, ausencia de radiolúcidez interradicular y periapical. Si las indicaciones son apropiadas para el recubrimiento pulpar indirecto, este tratamiento se realizará como un procedimiento en dos citas. (1) Primera cita:
No se altera esta cavidad sellada durante seis a ocho semanas. En muchos casos se puede requerir el uso de amalgama, resina compuesta o una corona de acero inoxidable como una restauración final para mantener el sellado. (1) Si tiene éxito esta eliminación preliminar de caries, la inflamación desaparecerá y el depósito de dentina de reparación subyacente permitirá la posterior erradicación de la caries sin que aparezca una exposición pulpar. Al cabo de 6 a 8 semanas, vuelve a tratarse el diente y se elimina la caries remanente.(1,2) Algunos clínicos han cuestionado la utilidad de abordar de nuevo y de volver a excavar. El segundo acceso somete a la pulpa al riesgo potencial de exposición debido a una excavación excesiva.(1,22) Leung(39) y Fairbourn(38) han podido demostrar una disminución importante de bacterias en lesiones cariosas profundas después de colocado hidróxido de calcio o ZOE reforzado por períodos de 1 a 15 meses. Por este motivo estos autores(38,39) sugirieron que podría no ser necesario reabrir para retirar la dentina cariosa mínima residual después del recubrimiento indirecto con hidróxido de calcio especialmente cuando la restauración final mantiene un buen sellado y el diente se encuentra asintomático. En preparaciones dentinarias de dientes humanos, se ha demostrado que la velocidad de depósito de la dentina secundaria a la reparación es por término medio de 14m/día. Sin embargo, la velocidad de formación de la dentina de reparación disminuye notablemente al cabo de 48 días.(40) Si el tratamiento inicial ha tenido éxito, cuando se vuelve a tratar el diente el proceso de caries parece haberse detenido. La textura cambia de esponjosa y húmeda a dura, y la caries aparece deshidratada.(1) En el sellado de las lesiones de caries profundas mediante óxido de cinc-eugenol e hidróxido de calcio se destruyen prácticamente todas las bacterias.(22) Tras la eliminación de la caries restante, puede realizarse una restauración permanente del diente.(1) Camp(20) sostiene "no es realista esperar que el sellado de una restauración dure indefinidamente. Una nueva contaminación de la caries restante podría llevar rápidamente a la afectación pulpar".(22) Recubrimiento pulpar directo El recubrimiento pulpar directo, fue mencionado por primera vez en 1756 por Phillip Pfaff, dentista alemán "El Grande". Él confeccionaba una pieza de metal, oro o plomo con forma de media arveja, con una concavidad en su parte interna para evitar que el metal entrara en contacto con la pulpa vital.(41) Actualmente es definido como el procedimiento que se aplica a la pulpa expuesta, en un intento por preservar su vitalidad.(41) Lasala(7) define al recubrimiento pulpar directo como la protección o recubrimiento de una herida o exposición pulpar mediante pastas o sustancias especiales con la finalidad de cicatrizar la lesión y preservar la vitalidad de la pulpa y refiere que por pulpa expuesta o herida se entiende la solución de continuidad de la dentina profunda, con comunicación de la pulpa con la cavidad de caries o superficie traumática, que se produce generalmente durante la preparación de cavidades y en las fractura coronarias. El recubrimiento pulpar directo se basa en la colocación de un agente biocompatible en el tejido pulpar saludable que inadvertidamente quedó expuesto durante la excavación de una caries o por una lesión traumática.(18) Dummett(22) et al. lo definen como la aplicación en la pulpa expuesta de un medicamento, cura o material odontológico para preservar su vitalidad. El objetivo del tratamiento es sellar la pulpa para evitar la filtración bacteriana, fomentar que la pulpa encapsule el sitio expuesto al iniciar un puente de dentina, y mantener la vitalidad de regiones subyacentes del tejido pulpar.(22,26) El éxito con el recubrimiento pulpar directo depende de que la pulpa coronaria y radicular este sana y libre de invasión bacteriana.(22,35) Watts y Paterson(42) afirman que la microfiltración bacteriana bajo diversas restauraciones produce daños pulpares en lesiones profundas. Por su parte, Cox(43) et al. demostraron que la cicatrización pulpar depende más de la capacidad del material de recubrimiento de evitar la microfiltración bacteriana que de las propiedades específicas del material propiamente dicho.(44) Como agentes de recubrimiento pulpar se han utilizado numerosos materiales y fármacos.(22,40) Aunque para el recubrimiento pulpar se han empleado diversos materiales, medicamentos, antisépticos, antiinflamatorios, antibióticos y enzimas, el más utilizado y habitualmente aceptado como agente de elección es el hidróxido de calcio.(6,43,45) Herman en 1930 introdujo el hidróxido de calcio como agente de recubrimiento pulpar. La terapia pulpar se hacia mediante la desvitalización con arsénico y otros agentes de fijación.(42) Éste demostró la formación de dentina secundaria sobre los lados amputados de las pulpas vitales cubiertas con hidróxido de calcio.(2) Zander(46) et al. confirmaron histológicamente que bajo los recubrimientos con hidróxido de calcio se formaban puentes dentinarios completos y con pulpa radicular sana. Tras estos primeros trabajos, numerosos estudios han publicado la utilización de diversas formas de hidróxido de calcio con unos porcentajes de éxito que van desde un 30 a un 98%. Las diferencias en estos porcentajes son atribuibles a muchos factores, como la selección de los dientes, los criterios utilizados para designar éxito y fracaso, las diferentes respuestas observadas en distintos animales de laboratorio, la duración del estudio y el tipo de hidróxido de calcio utilizado.(22) Seltzer(6) et al. afirman que cuando se aplica directamente hidróxido de calcio en el tejido pulpar, aparece una necrosis del tejido pulpar subyacente y una inflamación del tejido contiguo. Asimismo, se forma un puente de dentina en la unión del tejido necrótico con el tejido pulpar vital inflamado. Aunque el hidróxido de calcio es efectivo, no se conoce bien su mecanismo de acción. Cuando se aplican al tejido pulpar, los compuestos de alcalinidad similar a un pH de 11 producen una necrosis por licuefacción. El hidróxido mantiene el estado local de alcalinidad que necesita la formación de hueso o dentina. Por debajo de la región donde ocurre la necrosis por coagulación, las células del tejido pulpar subyacentes se diferencian hasta convertirse en odontoblastos y elaboran luego matriz de dentina. Leskell(47) señala que el hidróxido de calcio ha sido propuesto por su efecto antibacteriano sobre la dentina cariada el cual puede inactivar los microorganismos y sus componentes para que el tejido pulpar pueda producir dentina secundaria. Se ha postulado que, a partir de un recubrimiento pulpar directo con hidróxido de calcio, éste se extiende hacia el interior de la pulpa y participa en la formación de la dentina terciaria o de reparación.(34) Sin embargo experimentos realizados con iones radioactivos han demostrado que los iones de calcio procedentes del hidróxido no participan en la formación de la nueva dentina. Por lo tanto se comprobó que el calcio del puente de dentina procede de la circulación sanguínea.(48)La acción del hidróxido parece ser el resultado de la irritación menor del tejido pulpar subyacente que aparece poco tiempo después de su aplicación.(43) Aunque el procedimiento es cuestión de controversia diversos investigadores defienden la obturación directa de las exposiciones pulpar.(43,49) Se han probado como agentes de recubrimiento pulpar numerosos materiales adhesivos y sistemas de resina compuesta, con resultados de cicatrización de la pulpa y depósito de tejidos duros en el lugar de la exposición. Todos estos investigadores están de acuerdo en que la cicatrización no depende del material utilizado, sino de su capacidad para proporcionar un "sellado biológico".(1,43) En una comparación efectuada entre el recubrimiento pulpar mediante grabado ácido y resina compuesta o con Dycal®(LD.Caulk.Mildford,DE.USA) Pameijer et al demostraron la aparición de necrosis pulpar en un 45% de los casos y de puentes de dentina en tan sólo un 25% en comparación con un 7% de necrosis y un 82% de formación de puente con Dycal® (LD.Caulk.Mildford,DE.USA) respectivamente.(1)Aunque la obturación directa de las exposiciones pulpares es una técnica que ha adquirido gran popularidad, no se han publicado estudios histológicos sobre su evolución.(1) También se han publicado resultados excelentes(3,50,51) con la utilización de un nuevo agente biocompatible de recubrimiento pulpar; el agregado trióxido mineral (MTA). Al compararlo con el hidróxido de calcio, el MTA indujo la producción de un número mayor de puentes de dentina en un período de tiempo menor y con menos inflamación. La desventaja del procedimiento de este material es que después de su colocación han de pasar 3 a 4 horas para lograr que el material fragüe. Camp(20) et al. señalan que el tratamiento ideal de todas las exposiciones por caries excepto en los casos de dientes con raíces incompletamente formadas pudiera ser la extirpación de la pulpa y la obturación del conducto radicular; sin embargo el recubrimiento pulpar tiene todavía sus indicaciones. La selección del diente para el recubrimiento pulpar directo se basa en las mismas consideraciones anteriormente descritas; descartar signos de inflamación y degeneración pulpar irreversible.(1) La indicación clásica para el recubrimiento pulpar directo ha sido exposiciones mecánicas que están rodeadas con dentina sana.(1,20) Los dientes con calcificaciones de la cámara pulpar y los conductos radiculares no son candidatos para los procedimientos de recubrimiento pulpar. Estas calcificaciones señalan la presencia de traumatismos o de respuestas inflamatorias previas y hacen que la respuesta de la pulpa a la terapia sea menor.(44) Otras contraindicaciones para el recubrimiento pulpar directo incluyen un antecedente de odontalgias espontáneas y nocturnas, ensanchamiento del ligamento, signos radiográficos de degeneración a nivel periapical o del área de la furca, hemorragia incontrolable en el tiempo de exposición y exudado purulento o seroso por la exposición.(1) Frigoletto observó que las exposiciones pequeñas y una irrigación satisfactoria representan el mejor potencial para la curación.(22) Sin embargo, Stanley ha determinado que el tamaño de la exposición es menos importante que la calidad de la técnica de recubrimiento para evitar la contaminación y el traumatismo mecánico en el sitio de la exposición, y que la aplicación cuidadosa del medicamento al tejido pulpar hemóstaticamente controlado.(52)La misma importancia tiene la calidad de la restauración temporal o permanente para evitar microfiltración.(1) Las características sobresalientes del recubrimiento directo clínicamente éxitoso con o sin la formación de puente son: (1)
Cotton(53) observó que cuando hay una inflamación pulpar mínima, se forma un puente contra el material de recubrimiento, pero cuando la inflamación es más intensa, es posible que el puente se forme a una distancia de la exposición Se ha considerado que la formación de un puente de dentina es la condición obligatoria para el éxito en la respuesta a los procedimientos a los procedimientos de recubrimiento pulpar directo.(1) Por su parte, Weiss(54) et al. demostraron que puede existir una pulpa saludable por debajo de un recubrimiento pulpar directo aun cuando no exista un puente de dentina. Seltzer y Bender(6) demostraron que un puente de dentina no es tan completo como parece, lo cual finalmente puede llevar a reacciones pulpares indeseables. Cox(43) et al. encontraron que un 89% de los puentes formados en respuesta a los recubrimientos pulpares directos con hidróxido de calcio presentaron defectos de túnel, que permitían el acceso de productos de la microfiltración por debajo de la restauración hacia la pulpa. Encontraron inflamación pulpar recurrente en un 41% de todos los puentes formados en la muestra. En general se considera que las pulpas inadvertidamente expuestas y asintomáticas en el período preoperatorio son más aptas para sobrevivir cuando se realiza este tipo de recubrimiento. Esto se debe a que los vértices ampliamente abiertos y la gran vascularización de los dientes permanentes jóvenes favorecen el resultado satisfactorio de las técnicas de recubrimiento directo.(55) Pulpotomía vital La pulpotomía es la técnica más indicada en el tratamiento pulpar de dientes permanentes jóvenes con lesiones pulpares cariosas o traumáticas. Este procedimiento puede practicarse a diversos niveles, según el tamaño de la exposición y el estado de la pulpa en el sitio de la exposición.(1) Definición de la pulpotomía vital La pulpotomía vital es la exéresis o remoción parcial de la pulpa viva (generalmente la parte coronaria o cameral), bajo anestesia local, complementada con la aplicación de fármacos que, protegiendo y estimulando la pulpa residual, favorecen su cicatrización y la formación de una barrera calcificada de neodentina, permitiendo la conservación de la vitalidad pulpar. La pulpa remanente , debidamente protegida y tratada, continua de forma indefinida en sus funciones sensoriales, defensivas y formadora de dentina, esta última de básica importancia cuando se trata de diente jóvenes que no han terminado la formación radiculoapical.(7) Krakow(56) et al. la definen como la amputación completa de la pulpa coronaria, la cual es seguida de la aplicación de un medicamento en la entrada de los conductos radiculares, para inducir la formación de la raíz. Este procedimiento se realiza para mantener la vitalidad e integridad de la pulpa radicular remanente, para estimular el crecimiento de nueva dentina y como protección de la pulpa ante irritantes adicionales. Por su parte, Camp(20) señala que la pulpotomía consiste en eliminar el tejido pulpar con lesiones inflamatorias o degenerativas dejando intacto el tejido vital restante y revestirlo con un recubrimiento pulpar para favorecer la cicatrización en el lugar donde se ha hecho la amputación. Tradicionalmente el término pulpotomía ha implicado realizar la extirpación del tejido pulpar hasta la línea cervical. Sin embargo, la profundidad de la extirpación ha de determinarla el buen criterio del odontólogo .Debe eliminarse todo el tejido aparentemente inflamado para poder colocar así el material sobre un tejido pulpar sano sin inflamación.(1) El objetivo de este tratamiento es inducir el completo desarrollo radicular y el cierre apical.(57) Indicaciones de la pulpotomía vital
Dummett(22) et al. señala que en virtud de los mejores resultados clínicos, esta indicada en exposiciones cariosas y traumáticas de dientes permanentes jóvenes con cierre apical incompleto. Lasala(7) afirma que en dientes jóvenes (hasta 5 o 6 años después de la erupción), especialmente los que no han terminado su formación apical, con traumatismos que involucran la pulpa coronaria, como son las fracturas coronarias con herida o exposición pulpar o alcanzando la dentina profunda prepulpar. Contraindicaciones de la pulpotomía vital
Técnica de la pulpotomía vital El Martín(19) sugiere que primero es necesario eliminar la porción coronaria de la pulpa afectada y a continuación aplicar una solución de hidróxido de calcio directamente sobre el tejido pulpar sano para producir la necrosis de dicho tejido y sólo un leve grado de inflamación en el tejido pulpar subyacente. Seguidamente la acción de este fármaco induce la formación de un puente de dentina entre estas dos capas de tejido pulpar que protege a la pulpa radicular, lo cual permite que la vaina epitelial de Hertwig logre terminar el crecimiento radicular.\ Una vez establecido el diagnóstico, se anestesia el diente. Se realiza el aislamiento del diente a tratar para prevenir la introducción de microorganismos en los tejidos pulpares, hay que tener cuidado al colocar el dique de goma en un diente traumatizado. Si el diente presenta movilidad la grapa debe ser colocada en dientes vecinos no lesionados.(22) Se realiza una apertura de la cámara convencional con una fresa de diamante a alta velocidad con refrigeración por agua.(19) La amputación de la pulpa coronaria se hace con un excavador afilado o con una fresa redonda estéril grande tamaño # 6 u 8 o con una fresa de diamante redonda a alta velocidad. Lasala(7) sugiere que la fresa deberá ser más ancha que el conducto intermedio para disminuir el riesgo de una posible desinserción de la pulpa residual por torsión accidental. Pitt Ford(17) afirma que con el excavador es difícil crear una herida limpia sin dañar la pulpa subyacente. El uso de fresas a baja velocidad causa contusión y desgarre de la pulpa remanente, que conduce a una metamorfosis calcificante. En las pulpas dentales con exposiciones de origen traumático, tan solo se elimina el tejido aparentemente inflamado.(1,44) Ha demostrado que independientemente del tamaño de la exposición o del tiempo transcurrido , las exposiciones secundarias a traumatismo se caracterizan por una respuesta proliferativa con presencia de una inflamación que se extiende a pocos milímetros hacia el interior de la pulpa. Al eliminar este tejido inflamado e hiperplásico, se encuentra una pulpa dental sana.(44)En los dientes con exposición pulpar por caries, para llegar al tejido no inflamado es necesario extirpar tejido pulpar hasta una mayor profundidad.(44) Debe tenerse cuidado en extirpar todos los filamentos del tejido pulpar situado coronalmente al lugar de la amputación, ya que de otro modo aparecería una hemorragia imposible de controlar.(1) Camp(1) et al. sugieren que tras la amputación pulpar, se debe lavar por completo la preparación con suero fisiológico o agua estéril para eliminar los residuos; el agua se elimina por aspiración y con torundas de algodón. No debe aplicarse aire en la pulpa expuesta, puesto que provocaría desecación y lesión del tejido. La hemorragia se controla mediante la aplicación torundas de algodón ligeramente humedecidas en suero fisiológico y aplicado contra los muñones pulpares. No deben utilizarse torundas de algodón completamente secas, debido a que las fibras se incorporan en coágulo y podrían producir una hemorragia al ser retiradas.(1,17,19,23,54) Webber(58) señala que un muñón que continúe sangrando después de 5 minutos, usualmente es indicativo que el tejido pulpar esta afectado de manera irreversible. Una amputación más apical debe ser realizada para encontrar muñón de tejido sano. En los dientes multiradiculares la amputación coronaria se realiza al nivel de la entrada de los conductos radiculares. Pitt Ford(17) señala que no deben utilizarse productos químicos cáusticos ni medicamentos para mantener la salud de la pulpa radicular. Sin embargo, se ha publicado la utilización de hipoclorito sódico (NaOCl) para controlar la hemorragia pulpar antes de realizar el recubrimiento de la pulpa.(1) Según estudios previos se coloca hipoclorito sódico en el lugar de la exposición para conseguir la hemostasia. Además con éste método se destruyen las bacterias. El clorhidrato sódico no lesiona las células de la pulpa dental ni inhibe la cicatrización pulpar, la formación de células odontoblásticas ni la aparición de puente de dentina.(1) Una vez controlada la hemorragia, debe observarse que la herida pulpar sea nítida y no presente zonas esfaceladas, luego se procede a colocar el hidróxido de calcio sobre el muñón pulpar.(7) Se realiza una mezcla con un vehículo estéril (agua estéril o solución fisiológica)hasta obtener una consistencia espesa.(1) Webber(58) sugiere la colocación de sulfato de bario para aumentar la radiopacidad y lo recomienda en una proporción de 1:4 partes de hidróxido de calcio. Se coloca con cuidado la pasta en el muñón pulpar de 2 a 3 mm de espesor mediante un portaamalgamas.(17)Luego con un instrumento plástico de punta redondeada, se ajusta el hidróxido de calcio cuidadosamente contra el muñón pulpar.(1) Se coloca posteriormente una capa de cemento oxido de cinc-eugenol reforzado sobre el hidróxido de calcio por dos razones: para proteger contra la filtración de bacterias de la saliva y segundo proporcionar una base rígida contra la cual se pueda colocar la restauración final.(1,17,23,54) Pitt Ford(17) señala que la restauración permanente debe estar bien sellada; las provisionales se deterioran de forma invariable y se filtran en algún tiempo, lo que produce contaminación bacteriana y necrosis pulpar subsecuente. Si se emplea una restauración de resina composite no deben emplearse compuestos que contengan eugenol, puesto que interferirían con la reacción de fraguado de la resina.(1,23) Evolución y pronóstico de la pulpotomía vital Lasala(7) afirma que en los casos debidamente seleccionados y empleando la técnica antes expuesta, el curso postoperatorio acostumbra ser casi asintomático. Puede haber dolor leve durante uno o dos días después de la intervención, que cede fácilmente con analgésicos habituales. No obstante, se conceptúa como pronóstico reservado para la pulpa cuando hay dolores intensos o continuados. El diente debe someterse a una revisión clínica y radiográfica de manera periódica por lo regular a intervalos de 3 a 6 meses para vigilar la vitalidad pulpar y el desarrollo normal de la raíz o cierre.(49,59) El tiempo total de seguimiento varía según el grado inicial de maduración radicular; si la raíz estaba en una etapa muy temprana de desarrollo, su formación puede tomar de 1 a 2 años y las revisiones se hacen por lo menos hasta los 4 años.(1,17,19,54) Arens(23) afirma que la radiografía de control debería revelar la formación de un puente en 4 a 6 semanas. Sin embargo, Lasala(7) señala que éste puede demorar 1 a 3 meses para su formación. En los períodos de observación se debe evaluar tanto ésta calcificación como la continuación del desarrollo radicular. Schoder y Sundstrom investigaron la histología de reparación en pulpotomías experimentales, con intervalos entre la amputación y la extracción de 7 día, un mes y tres meses. A los 7 días existe una barrera de colágeno debajo de una zona de necrosis por coagulación. Al mes, se observa un tejido similar al hueso y la formación incipiente de tejido similar a dentina. A los tres meses la barrera consistía en dos capas distintas osteoide y dentinoide, respectivamente.(7) Después de este período, se observaron células semejantes a odontoblastos en función y apariencia, en la capa pulpar adyacente a un tejido similar a la predentina.(7) Camp(20) et al. señalan que si bien en estos casos no es posible determinar el éxito histológico, el éxito clínico se valora por la ausencia se signos clínicos o radiológicos de enfermedad, por la presencia del puente dentinario (clínica y radiográficamente) y por la presencia de un desarrollo continuo de la raíz. Seltzer(6) y Langeland(60) opinan que los procedimientos de pulpotomía ocasionan de forma invariable una calcificación progresiva de los conductos. Por lo tanto, después de un desarrollo completo de la raíz estos investigadores defienden la extirpación del tejido pulpar restante y la realización de tratamiento endodóntico. Recomiendan el tratamiento endodóntico a causa de la elevada incidencia de calcificación continuada. En un estudio de seguimiento sobre el éxito de pulpotomías durante un período de 1 a 5 años, los investigadores extirparon las pulpas por motivos restauradores encontraron unos resultados histológicos normales. Llegaron a la conclusión que tras una pulpotomía en dientes fracturados accidentalmente y con exposiciones pulpares, las lesiones observadas en las pulpas no representan signos histológicos suficientes para indicar una pulpectomía de rutina.(1) Camp(20) et al. señalan que cuando se ha desarrollado la raíz está contraindicada una nueva intervención para extirpar la pulpa y realizar una obturación del conducto radicular, a menos que por otras consideraciones relacionadas con la restauración, como la necesidad de reintervenir para colocar un perno de retención. Lasala(7) sugiere realizar controles sistemáticos a los 6,12,18 y 24 meses después de la intervención, durante los cuales se verificará: ausencia total de síntomas dolorosos, presencia del puente de dentina de diversas formas y espesores pero fácilmente apreciables en la radiografías. En especial en los dientes inmaduros se aprecia gradualmente en los lapsos indicados el estrechamiento progresivo en el lumen de los conductos y sobre todo la terminación de la formación radicular y apical. Apicoformación El tratamiento endodóncico de los dientes permanentes sin pulpa y con un ápice abierto, amplio y en forma de trabuco ha constituido desde siempre un reto para los odontólogos. Antes de la introducción de las técnicas de cierre apical, el tratamiento habitual de este problema era quirúrgico. Aunque éste podría tener éxito, la existencia de consideraciones mecánicas y psicológicas implicaban numerosas contraindicaciones.(1) En los dientes sin pulpa y con un ápice incompletamente formado, las delgadas y frágiles paredes dentinarias dificultan la formación de un sellado apical. La permeabilidad del orificio apical es variable, desde casi cerrado hasta un tipo divergente o en "trabuco". Cuando para conseguir un sellado se eliminaba parte de la raíz, la relación corona-raíz resultante era adversa para la restauración coronaria subsecuente. Como esta situación se presentaba generalmente en niños, era de desear un abordaje menos traumático .(1,17,18) Las consideraciones teóricas sugieren que el crecimiento de la raíz con dentina y cemento histológicamente solo es posible en los casos en que conserva su función la vaina epitelial radicular de Hertwig. Por lo tanto, cuando se trata un diente inmaduro con infección crónica, el único tipo de cierre del extremo de la raíz que puede anticiparse es la oclusión calcificada. (1) Definición de apicoformación De acuerdo a la AAE (Asociación Americana de Endodoncia), la apicoformación es un método que induce la formación de una barrera calcificada en un diente con ápice abierto o la continuación del desarrollo apical de una raíz incompletamente formada en dientes con pulpa necrótica.(61) La apicoformación es el tratamiento que se realiza en un diente incompletamente formado y con necrosis pulpar, con la finalidad de inducir o permitir la formación de una barrera calcificada que oblitere el orificio apical o que permita el desarrollo radicular completo.(62) Por su parte, Erdogan(24) la define como un método de inducción de cierre apical a través de la formación de un tejido mineralizado en la región apical de la pulpa de un diente sin vitalidad pulpar con una raíz incompletamente formada y sin cierre apical. Soares y Golberg(63) señalan que en los dientes con desarrollo radicular incompleto y con un diagnóstico de necrosis pulpar es muy importante la limpieza adecuada del conducto radicular y el relleno tridimensional del espacio existente con materiales que proporcionen las condiciones o induzcan el cierre de la apertura apical con un tejido mineralizado que permita, en el futuro, el tratamiento endodóntico definitivo. Canalda(64) afirma que en ocasiones se puede producir el cierre apical, con aumento de la longitud radicular previa y estrechamiento de la luz del conducto, sin embargo, lo más habitual es que se produzca la formación de una barrera calcificada en el orificio apical, quedando la longitud similar a la existente en el momento de iniciar el tratamiento y sin modificaciones en las dimensiones de la luz del conducto. Por estos motivos se desarrolló la técnica de apicoformación, con la que se pretende estimular la formación de una barrera apical de tejido duro que sirva como tope para realizar una buena compactación de la gutapercha en el conducto radicular. Indicaciones de la apicoformación Breillat y Laurichesse distinguen dos situaciones clínicas en las cuales se puede aplicar un tratamiento de apicoformación:(64)
Técnica de apicoformación
Sin embargo, Soares y Golberg(63) sugieren que es importante un control clínico y radiográfico al primer mes y luego cada 3 meses en el cual se debe evaluar, la homogeneidad de la obturación con la pasta de hidróxido de calcio y la condición de los tejidos ápico-periápicales. Cuando la radiografía de control muestre áreas vacías en el conducto se debe volver a colocar el medicamento. Si es necesario volver a colocar el hidróxido de calcio se recomienda, después de realizar el aislamiento absoluto y la remoción de la restauración provisional, colocar una jeringa con solución fisiológica calibrando la aguja 2mm menos de la longitud de trabajo, utilizar una lima tipo K # 35 0 40 para ayudar en la remoción del hidróxido de calcio. Si por el contrario, se observan signos de fracasos (fístulas, tumefacción, persistencia o aumento de tamaño de la lesión) se debe reevaluar el tratamiento realizado, mejorar la preparación del conducto y volver a colocar hidróxido de calcio.(63) Al ser evidente el cierre apical, se procede a aislar el diente y a eliminar la pasta del interior del conducto con irrigación abundante. Luego se procede a comprobar de forma táctil la presencia de la barrera calcificada con una lima de grosor máximo # 20,sin embargo otros autores para mayor seguridad sugieren realizar este procedimiento con una punta de papel invertida y minimizar el riesgo de romper el puente neoformado.(19,63) Luego se procede a secar el conducto y se obtura de manera definitiva con la técnica de cono hecho a la medida, ésta técnica, según Somer et al. se elabora un cono grueso de gutapercha calentando varios conos pequeños y arrollándolos entre dos losetas de vidrio, se obtura con la parte mas ancha hacia el ápice y la más estrecha hacia incisal, es decir, en sentido invertido, y luego se condensa lateralmente con conos adicionales. Hoy en día también se pueden utilizar otras técnicas como la gutapercha termoplastificada.(7) Pitt Ford(17) afirma que para el éxito del cierre apical es crítico un sellado temporal eficaz entre citas, si este se pierde, las bacterias tienen acceso al conducto y recurre la inflamación apical y fracasa el procedimiento de apicoformación. Fernández et al. Señalan que la formación de tejido calcificado que oblitere la apertura apical se produce, en general, en un período entre 9 y 18 meses. En muchas ocasiones, se aprecia en la radiografía la formación de una barrera calcificada apical. Hay que tener en cuenta que el cierre más tardío es el vestíbulo palatino y en la radiografía solo se observa el diente en sentido mesiodistal, por esto se recomienda después de observar el cierre en la radiografía esperar entre 1 y 2 meses mas para asegurar la formación de una barrera completa.(63) Lasala(7) afirma que no es necesario lograr un cierre completo apical para obturar de forma definitiva el diente; basta conseguir un mejor diseño apical que permita una buena obturación con conos de gutapercha. Lasala refiere que la dirección y desarrollo apical es variado, y cabe destacar los siguientes tipos clínicos:
Materiales utilizados para la apicoformación Son múltiples los materiales que aplicados en el interior del conducto radicular que persiguen la consolidación de una barrera apical con el fin de evitar la extrusión de material de obturación durante el tratamiento endodóntico en los dientes con ápices inmaduros.(75)Se ha descrito la colocación de diversos medicamentos en el conducto para inducir el cierre del extremo radicular, como el tricresol y formalina, pastas antibióticas, fosfato tricálcico, hidróxido de calcio.(7) Lasala(7) afirma que desde 1964, la terapia de los dientes inmaduros, con el foramen abierto y divergentes que necesitan tratamiento endodóntico, consiste en emplear la técnica de apicoformación, mediante la inducción de pastas alcalinas de hidróxido de calcio. Aguilar a mediados de la década de los 50, observó experimentando el ocaléxico que, en algunos dientes inmaduros y a lo largo de las sucesivas curas con el hidróxido de calcio recién sintetizado o puro, se formaba una barrera apical de cemento o tejido duro que permitía la obturación convencional del conducto con gutapercha.(55)Por su parte, Marmasse menciona el empleo de pastas resorbibles (Calxyl, pasta de Walkhoff) con el objeto de conseguir la apicoformación.(7) En 1960, Cooke(65) et al. Comprobaron que los ápices inmaduros de dientes con pulpa necrótica podrían continuar su desarrollo después de colocar una cura temporal de una pasta de oxido de cinc y eugenol. Moodnik sugiere que las enzimas del tejido de granulación promueven la calcificación del conducto con la previa eliminación de los irritantes presentes, a pesar de una infección apical, la invaginación periodontal dentro del conducto puede ayudar secundariamente a la formación de neocemento.(7) Ball(66) utilizó una pasta poliantibiótica radiopaca en el interior de un conducto para inducir el cierre apical y, el resultado fue exitoso ya que detectó material calcificado cerca del ápice. El cierre apical se observó cinco meses después del inicio del tratamiento. Kaiser y Bazler presentaron casos de apicoformación de dientes con pulpa necrótica empleando una mezcla de hidróxido de calcio y paramonoclorofenol alcanforado. Por otra parte Maisto y Capurro publicaron el mismo año análogos resultados. Utilizando una mezcla de yodoformo, hidróxido de calcio y agua con metilcelulosa(7). Por su parte, Frank desde 1965 a 1968 ha comunicado en infinidad de trabajos su técnica de apicoformación utilizando la mezcla de hidróxido calcico-paraclorofenol alcanforado. Dylewsky(67)deseaba comprobar el desarrollo radicular en dientes no vitales incompletamente formados, utilizando una pasta de hidróxido de calcio con paramonoclorofenol alcanforado, observando solo una reparación apical, caracterizada por una actividad proliferativa del tejido conectivo que se diferencio en osteodentina. Javelet(68) et al. Estudiaron el efecto del pH en la formación de una barrera apical en dientes inmaduros de monos y, concluyeron que, la alta alcalinidad del hidróxido de calcio induce el desarrollo de barreras calcificadas, por el contrario un pH bajo se da poco o ausencia del desarrollo de la barrera apical en dientes donde se utilizó cloruro de sodio el cual su pH es de 4,4. El elevado pH del hidróxido de calcio podría activar las ATPasas y las fosfatasas alcalinas por lo que induce la formación de tejido duro; disuelve los tejidos necróticos y cierra los conductillos dentinarios por lo que se reduce la permeabilidad dentinaria.(64,69,70) Por su parte, Leonardo(71) afirma que el hidróxido de calcio mantiene la vitalidad de los tejidos periapicales e induce y acelera el cierre apical mediante la deposición de material calcificado. Durante años, el hidróxido de calcio ha sido considerado el material de elección ya que tiene gran potencial osteogénico y un alto porcentaje de éxito.(60,72) Sin embargo, la terapia con hidróxido de calcio tiene algunas desventajas como la variabilidad del tiempo del tratamiento y la impredecibilidad del cierre apical. Esto ha producido la búsqueda continua de técnicas y materiales que podrían permitir el cierre apical continuo en dientes con ápices inmaduros.(70) Nevins(63) et al. en su estudio evaluaron la inducción de tejido duro en dientes de monos con ápices inmaduros utilizando un substrato resorbible de un gel fosfato colágeno-calcio. Ellos observaron la formación de un nuevo tejido muy parecido a cemento o hueso el cual fue depositado en la dentina del conducto radicular cerrando el espacio del mismo. La estructura del ligamento periodontal fue reformada a nivel apical y no fue observada anquilosis entre el diente y el hueso circundante. Las proteínas óseas morfogenéticas han sido utilizadas recientemente para promover la formación de hueso.(70) Sampath et al. evaluaron histológicamente la extensa actividad osteogénica en implantes que contenían colágeno y vehículos con diferentes cantidades de proteína osteogenica-1(OP-1). Ellos encontraron que el sólo vehículo no inducía la formación ósea. Los implantes que contenían la OP-1 inducían la formación de hueso endocondreal en forma de dosis dependientes. La OP-1 también ha sido utilizada como agente de recubrimiento pulpar para inducir la formación de dentina.(70) Shabahang(70) et al. Realizaron un estudio de comparación utilizando la proteína osteogenica &endash;1, hidróxido de calcio y MTA para inducir el cierre apical de dientes inmaduros en perros. La evaluación histológica de las muestras tratadas con MTA demostraron que 13 de 14 (93% raíces tratadas con éste material tenían un cierre apical con la formación de una barrera calcificada en las secciones estudiadas. Por el contrario, solo 5 (38,5%) de 13 raíces tratadas con hidróxido de calcio y OP-1 exhibieron un cierre apical. Sin embargo, las raíces tratadas con MTA y OP-1 indujeron un área de formación de tejido duro que fue una ventaja en ambos sobre los dientes tratados con hidróxido de calcio. Somercon(74) et al. Demostraron en un estudio in Vitro que el alendronato es éxitoso en la aceleración del crecimiento del tejido apical duro. La concentración utilizada en este estudio (10-9M) estimula los osteoblastos para la formación ósea y a los odontoblastos para la formación de dentina. Esto indica que este material podría ser utilizado in vivo para acelerar la apicoformación en dientes con ápices inmaduros. El agregado de trióxido mineral (MTA) cuyas primeras referencias en la literatura aparecen en 1993, se introduce como un cemento con gran diversidad de usos dentro de los cuales se encuentra como un material de obturación de conductos radiculares.(76) Diversos estudios.(77,78) han demostrado regeneración de los tejidos periapicales tales como: ligamento periodontal, hueso y cemento cuando éste material (MTA) se ha utilizado en procedimientos endodónticos. Recientes investigaciones han podido constatar que el agregado de trióxido mineral induce la formación de tejido apical y su uso esta asociado con una menor inflamación de la zona que otros materiales probados.(75) Otro estudio que sustenta la utilización del MTA, es el realizado por Tittle.(79) et al. donde se comparó la efectividad del agregado de trióxido mineral como barrera de obturación apical, con capacidad para estimular el cierre apical de tres factores de crecimiento óseos. Los autores concluyen que los factores de crecimientos óseos juegan un papel importante en la formación y resorción ósea, pero sus efectos en un área inflamada son escasamente conocidos, donde se utilizó MTA las lesiones eran significativamente mas pequeñas, por lo que el MTA puede utilizarse como material de obturación en una sola sesión en dientes con ápice abierto. A diferencia de las técnicas convencionales de apicoformación, el uso de MTA busca crear una barrera rígida contra la que se pueda compactar el material de obturación sin tener que esperar la formación de la barrera de osteocemento y a su vez induce la formación de dicha barrera después de finalizado el procedimiento.(75) El procedimiento clínico recomendado por Torabinejad y Chivian.(77) en la utilización del MTA en dientes permanentes con necrosis pulpar y ápices incompletamente formados, es el siguiente: después de anestesiar, aislar con dique de goma, y preparar un acceso adecuado, el sistema de conductos radiculares, se debe desinfectar, utilizando instrumentos e irrigación con NaOCl. Para desinfectar el conducto radicular, se introduce el hidróxido de calcio como medicamento intraconducto por una semana. Después de irrigar el conducto radicular con NaOCl y eliminar el hidróxido de calcio, se seca con puntas de papel absorbente, se mezcla el polvo del MTA con agua estéril y se lleva la mezcla con un porta amalgama grande al conducto. Posteriormente, se condensa el MTA hacia el ápice radicular de la raíz con condensadores o puntas de papel. Creando un tapón apical de MTA de 3 a 4 mm. y se controla su extensión radiográficamente. Al-Kahtani(80)et al. realizaron un estudio in Vitro en el cual evaluaron la capacidad de sellado del MTA en diferentes espesores colocados en dientes como retroobturación y sus resultados demostraron que el espesor ideal fue de 5mm debido a que se evito completamente la filtración bacteriana. Si la colocación de la barrera apical no se logra en el primer intento, lavar el MTA con agua estéril y repetir el procedimiento. Colocar una torunda de algodón húmeda en el conducto y cerrar el acceso preparado de la cavidad con un material de restauración temporal por lo menos de tres a cuatro horas. Obturar el resto del conducto con gutapercha o con resina en dientes con paredes delgadas, como está indicado y sellar la cavidad de acceso con una restauración definitiva. Evaluar la cicatrización perirradicular clínica y radiográficamente.(77) El mecanismo de formación de cemento sobre el MTA, como material de obturación apical, no está claro. Basado en los resultados de estudios del material en retro obturaciones y en reparación de perforaciones; al parecer el MTA es probablemente capaz de la activación de los cementoblastos al producir la matriz de la formación del cemento. Posiblemente, por su capacidad de sellado.(77,81), su alto pH.(77),o a la liberación de sustancias que activan los cementoblastos para formar una matriz para la cementogénesis.(82) Sin embargo. Banchs y Trope(83) reportan un caso en el cual aplican una nueva alternativa para la revascularización de dientes permanentes inmaduros con periodontitis apical. Ellos realizaron la desinfección del conducto sin instrumentación mecánica solo con una irrigación copiosa y la combinación de tres antibióticos. Después de que el protocolo de desinfección es completado, el ápice es irritado mecánicamente para iniciar un sangramiento en el conducto radicular y producir un coágulo de sangre al nivel de la unión cemento-esmalte, el cual actúa como una matriz de crecimiento de un nuevo tejido dentro del espacio pulpar similar a la pulpa necrótica después de un traumatismo o injuria. Luego se realiza un sellado profundo del acceso coronario con Cavit®(ESPE, seefeld, Germany) y MTA. En este caso, los autores hacen referencia que aun cuando una lesión apical grande estuviera presente, es probable que algún tejido de pulpa vital y vaina epitelial radicular de Hertwig permaneciera. Cuando la desinfección del conducto y las condiciones inflamatorias se han eliminado, estos tejidos pueden proliferar. Este caso tiene un seguimiento de 2 años el cual se ha considerado exitoso ya que las paredes radiculares formadas son fuertes y el ápice se ha desarrollado de una manera normal. En cuanto a la predictabilidad de este procedimiento y el tipo de tejido formado en este caso debería ser estudiado. (83) Sin embargo, los autores(83) refieren que los beneficios son grandiosos comparados con las finas paredes susceptibles a fracturas que se forman con las otras técnicas, pero si con éste procedimiento no se ve ningún tipo de desarrollo radicular a los 3 meses, los procedimientos más tradicionales apicoformación entonces pueden ser comenzados. Evolución y pronóstico de la apicoformación Martín(19) señala que el hecho de que se consiga el cierre apical y el posterior tratamiento de conductos no siempre es sinónimo de éxito completo, ya que estos dientes son mucho más frágiles y cualquier nuevo traumatismo puede ocasionar un daño irreparable. A largo plazo este procedimiento puede fracasar al fallar el tratamiento restaurador, por lo que se realizarán evaluaciones periódicas cada tres meses. (1,26). Es por ello que algunos autores recomiendan técnicas de refuerzo intracoronario radicular con resinas adhesivas de última generación con la finalidad de aumentar criterios de resistencias en la reconstrucción de estos dientes, tal es el caso de espigas de plásticos transparentes denominadas Luminex (dentaus USA,Nueva York,NY) que , al permitir la trasmisión de la luz a través del conducto radicular se consigue el curado de toda la resina. (19,26) Sin embargo, Pitt Ford.(17) afirma que los casos con éxito se caracterizan por lo siguiente: ausencia de signos o síntomas de lesión apical y una barrera calcificada a través del ápice según aparece radiográficamente, o con mayor frecuencia con el sondeo táctil cuidadoso mediante una lima. Casi siempre la raíz está corta y con punta más roma de lo normal.(17) Soares y Golberg(63) señalan que en el tratamiento de los dientes con ápices incompletamente formados y diagnóstico de necrosis pulpar, el control de la infección es un paso fundamental para la obtención del cierre y al mismo tiempo, la reparación de la lesión periapical. Hay factores como la amplitud del conducto, su morfología y el grado de desarrollo apical que son importantes en la evaluación del pronóstico del tratamiento. Si las medidas terapéuticas fueron satisfactorias es muy probable el éxito del tratamiento. Histología de la apicoformación Aunque se conoce el hecho clínico de la apicoformación y su comprobación instrumental y radiográfica, son pocos los trabajos publicados sobre la histopatología de reparación.(7) Para Steiner et al. 1968, para el momento que publicaron su trabajo, no se conocía con exactitud la identidad histológica del ápice recién formado, que podía ser dentina, cemento, hueso o tejido fibroso calcificado.(7) Varios autores afirman que si la pulpa se encuentra necrótica pero la vaina epitelial de Hertwig no está destruida, el desarrollo radicular continua(17,36), por lo tanto se puede realizar el tratamiento de conducto convencional sin colocar medicación intraconducto previamente. En contraposición, Canalda(64) sugiere que la reparación histológica del ápice se debe a la presencia de las células periodontales, cementoblastos y osteoblastos, sin la intervención de la vaina epitelial. Los estudios histológicos informan repetidamente sobre la ausencia de la vaina epitelial. Por regla general, tras una apicoformación no ocurre un desarrollo radicular normal. Por el contrario, al parecer las células del tejido conjuntivo adyacente se diferencian y convierten en células especializadas, asimismo también ocurre un depósito de tejido calcificado junto al material de obturación.(26) Canalda(64) afirma que morfológicamente, se pueden distinguir dos tipos de reparación después de una apicoformación: un ápice anatómico y una barrera apical. Dentro de lo que él denomina un ápice anatómico se observa la formación de un ápice con las mismas características que el diente contralateral, con alargamiento de la longitud radicular inicial. Esto es factible conseguir cuando existe concordancia entre el desarrollo radicular y la edad del paciente, siempre que no se haya producido una infección del periápice y no se haya destruido los restos de la pulpa y la vaina epitelial de Hertwig. (64) Por el contrario, en la formación de la barrera apical se observa el desarrollo de un tejido calcificado, de mayor o menor grosor, obliterando la zona apical del conducto radicular, manteniéndose la longitud radicular inicial. Ésta se produce al desaparecer la infección del interior del conducto. Por debajo de la zona de necrosis hística producida por el hidróxido de calcio, se produce la proliferación de fibroblastos que segregan colágeno. A su mineralización contribuyen los cristales de carbonato cálcico, que precipitan en la zona lesionada al liberarse los iones de calcio. Posteriormente, los iones de calcio y fosfatos plasmáticos son la fuente para la calcificación de la matriz colágena segregada.(64) Con el tiempo, a nivel de la periferia del orificio apical, proliferan cementoblastos y osteoblastos que segregan matriz cementoide y osteoide que luego se calcificará. La barrera apical que cierra el ápice , está formada por una masa de tejido calcificado a la que se acostumbra denominar osteocemento, por presentar características histológicas poco definidas.(11) Sin embargo, Soares y Golberg(63) señalan que el cierre apical puede producirse de cuatro diferentes maneras:
En los estudios clínicos realizados sobre la apicoformación se han publicado diversos tipos de cierre apical. (26) Heithersay publicó un estudio sobre 21 casos de dientes con ápices inmaduros y pulpa necróticas que fueron tratados con hidróxido de calcio y metilcelulosa en un período de 14 a 75 meses. Éste autor realizó los hallazgos histopatológicos y encontró: que el nuevo tejido se formó tanto dentro como fuera del conducto y consistió en tejido pulpar, dentina interglobular, cemento y fibras de la membrana periodontal. Amplias capas de cemento celular y acelular, cubriendo no solamente el tejido neoformado sino que se extendían más allá de la unión con la raíz primitiva.(7) Rara vez existe la oportunidad de estudiar la fina estructura del tejido que se forma como consecuencia de un procedimiento de apicoformación. Es así como Baldassari(84) et al. en su estudio describen los componentes histológico y el análisis de la ultraestructura de una barrera calcificada que se formó sobre el ápice. La superficie externa pareció extenderse de una manera parecida a una cubierta en el ápice radicular, mostrando la topografía irregular con indentaciones y convexidades en toda la superficie. Las secciones histológicas mostraron un efecto de capas, la capa externa pareció ser densa y de cemento acelular. Esto rodeaba una mezcla central de densidad irregular de fibrocolágeno, tejido conectivo que contenía material granular extraño que podría ser cemento sellador y un material eosinófilo amorfo hialino. Además se presentaban áreas integradas con fragmentos irregulares sumamente mineralizados de apariencia similar a calcificaciones distróficas, también se encontraron superficies que semejaban tejido adiposo, y un tejido con componentes similares a la médula aunque esto sea especulativo, y se presento muy poco inflamación celular infiltrada. (84) Lasala(7) afirma que es indiscutible que la reparación de los tejidos se produce cuando los tejidos periapicales "perciben" que ha desaparecido la infección, que no existen microorganismos, sustancias extrañas o toxicas, ni proteínas degradadas. Es posible que a pesar del éxito conseguido con el hidróxido de calcio, lo básico e imprescindible sea eliminar del conducto aquello que hostiga y perturba, para que así esos grandes colaboradores del odontólogo denominados vaina de Hertwig, cemento, hueso o tejido conjuntivo poco diferenciado, puedan reparar específicamente la lesión y desarrollar la apicoformación.
Materiales y Método Población y Muestra La población para este estudio estuvo constituida por 918 casos que fueron tratados por los estudiantes del Postgrado de endodoncia de la Facultad de Odontología de la Universidad Central de Venezuela durante el período comprendido entre enero de 2002 y abril 2005. Se seleccionaron aquellos casos en los cuales se les aplico alguna terapia empleada en los dientes incompletamente formados tales como: recubrimiento pulpar indirecto (RPI), recubrimiento pulpar directo(RPD), pulpotomía vital (PV) y apicoformación(ATC). Fueron excluidos todos aquellos casos en los cuales se les aplico otro tipo de terapia endodóntica tales como: tratamiento de conductos(TC), repetición de tratamiento de conductos(RTC), cirugía apical (CA) y repetición de tratamiento de conducto mas cirugía apical(RTCCA) Técnicas e instumentos de recoleción de datos Se obtuvo de la coordinación del Postgrado de Endodoncia el listado de pacientes atendidos durante período comprendido entre enero de 2002 y abril de 2005, con su correspondiente número de historia clínica. En el departamento de archivo de la Facultad de Odontología se ubicaron las historias clínicas y de ellas se obtuvieron las historias de endodoncia de la cual se obtuvo la información requerida para el alcance de los objetivos planteados. Los datos fueron recolectados en un instrumento especialmente diseñado para este fin.
Análisis de los datos La información que se recolectó en la investigación fue sometida a tratamiento estadístico, para tal fin fue utilizada la base de datos (Microsoft Excell® de Office 97) y sometidos a un análisis estadístico a través del programa SPSS (Statistic Parket for Social Science). En tal sentido, se elaboraron tablas de frecuencia que se tomaron como base para el análisis cuantitativo. Los resultados obtenidos se presentaron en forma de tablas.
Resultados Se atendieron un total de novecientos dieciocho casos durante el período comprendido entre enero de 2002 y marzo de 2005 en el postgrado de endodoncia Universidad Central de Venezuela. La tabla I muestran la distribución según edad y sexo de la población objeto de estudio.
Tabla I. Distribución de la Población total según Edad y Sexo. Escala de 8 a 88 con su equivalente en 1 al 9. Fuente: Datos de la investigación
Los casos tratados con terapias empleadas en dientes incompletamente formados tales como: recubrimiento pulpar indirecto, recubrimiento pulpar indirecto, pulpotomía vital y apicoformación se encuentran distribuidos en la tabla II. Solamente aparece en el grupo estudiado un caso de recubrimiento pulpar directo representando un (0,1%) y diez casos para apicoformación representando (1,1%) del total estudiado.
Tabla II. Frecuencia relativa de las terapias endodónticas empleadas en dientes incompletamente formados realizadas en el postgrado de endodoncia de la Universidad central de Venezuela periodo de enero 2002 - abril 2005
Al indagar sobre la edad de los casos donde se realizó Recubrimiento Pulpar Directo y Apicoformación se encontró que pertenecían a las clases 1 (8-16 años) y 2 (17-25 años). De los casos tratados con las terapias de dientes incompletamente formados se destacan un mayor porcentaje para el sexo masculino tanto en la clase 1 como en la clase 2.(tabla III y gráfico 1)
Tabla III. Frecuencia relativa según sexo y edad de las terapias endodónticas empleadas con mayor frecuencia en dientes incompletamente formados realizadas en el postgrado de endodoncia de la Universidad Central de Venezuela en el periodo de enero 2002 - abril 2005.
Gráfico 1. Frecuencia Relativa según Sexo y Edad de Terapias Endodónticas Empleadas con mayor Frecuencia en Dientes Permanentes Incompletamente Formados. Postgrado de Endodoncia de la Universidad Central de Venezuela. Período de enero 2002 - abril 2005.
Al analizar los datos relativos a las terapias utilizadas para dientes incompletamente formados se reporta que los dientes tratados fueron los incisivos superiores y un molar inferior ,presentándose las mayores frecuencias en los incisivos centrales, el diente 11 fue el que alcanzó un 36,4% del total de casos tratados. (tabla IV y Gráfico 2).
Tabla IV. Frecuencia absoluta y relativa de dientes tratados con terapias endodónticas Empleadas con mayor Frecuencia en Dientes Permanentes Incompletamente Formados. Postgrado de Endodoncia de la Universidad Central de Venezuela. Período de enero 2002 - abril 2005.
Gráfico 2. Frecuencia Relativa de Dientes Tratados con Terapias Endodónticas para Dientes Incompletamente Formados, en el Postgrado de Endodoncia de la Universidad Central de Venezuela durante el período enero 2002 &endash; abril 2005.
Discusión El grado de desarrollo radicular junto con la condición del tejido pulpar constituye uno de los factores determinantes al seleccionar el tratamiento endodóntico en dientes incompletamente formados. Si la raíz esta en desarrollo y la pulpa esta vital entre los posibles tratamientos se encuentran el recubrimiento pulpar indirecto, el recubrimiento pulpar directo y la pulpotomía vital. Por el contrario, si el tejido se encuentra necrótico se indica la apicoformación. (7,22,63) Todas estas terapias se indican en la historia de endodoncia en el postgrado de la Universidad Central de Venezuela como alternativas de tratamientos en los dientes incompletamente formados. De acuerdo con los resultados de este estudio de los 918 casos solo 11 casos fueron tratados con este tipo de terapias. En un 1,1% de los casos se realizó la apicoformación, cuyo fin es la inducción del cierre apical mediante la aposición de un tejido calcificado que permita la formación de una matriz contra la cual se puede compactar el material de obturación del conducto radicular.(19) Es preciso destacar que el desarrollo radicular tras la apicoformación suele dar lugar a una configuración algo diferente a la que la raíz adquiere tras un desarrollo normal. La raíz puede ser más corta, el conducto más amplio y las paredes laterales finas o incluso con un estrechamiento invertido.(19) Este estudio destaca que la segunda terapia en casos de dientes incompletamente formados es el recubrimiento pulpar directo(RPD), cuyo objetivo es sellar la pulpa para evitar la filtración bacteriana, fomentar que la misma encapsule el sitio expuesto al iniciar un puente de dentina y mantener la vitalidad de regiones subyacentes del tejido pulpar.(22,26) Las edades comprendidas entre 8 y 25 años fueron las más frecuentes en los casos tratados con estas terapias, tomando en cuenta que las lesiones de caries y los traumatismos dentarios constituyen la causa más frecuente de las lesiones pulpares en dientes permanentes jóvenes.(8) En este sentido, Dummett (22) et al. refieren que la mayor parte de las lesiones dentales ocurren durante los primeros dos decenios de edad y el periodo mas propenso a accidentes es entre los 8 y los 12 años. También señalan que los niños tienden a lesionarse con mayor frecuencia que las niñas con una proporción que varía entre 2:1 y 3:1 lo cual coincide con los resultados de este estudio en el cual el sexo masculino obtuvo el mayor porcentaje 45,4% en la clase 1 y un 18,2% en la clase 2. Los incisivos anterosuperiores son los dientes tratados con mayor frecuencia con estas terapias, Parkin en su estudio reveló que de cada 1000 casos evaluados 966 eran incisivos centrales superiores.(7) En este estudio el Incisivo central superior representó un 63,6% de los casos, en especial el incisivo central superior derecho. A diferencia de las terapias endodónticas empleadas en dientes completamente formados, en los casos de dientes que no han culminado su formación radicular resulta importante tomar en cuenta el diagnóstico, la asistencia inicial oportuna, la calidad del tratamiento ,la evaluación de control y el cuidado son componentes importantes para lograr resultados exitosos a largo plazo.(18)
Conclusiones
Bibliografía
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||