|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
En esta sección vamos a contar con la colaboración de diversos profesionales que van a escribir en relación a diversos temas de interés odontológico y no exclusivamente endodónticos. Para darnos su opinión, o manifestarnos si desea algún tópico en particular, por favor escríbanos a carlosboveda@carlosboveda.com y con gusto haremos lo posible por responder a su inquietud. Si quiere consultar todos los trabajos expuestos en estas páginas, puede revisar la lista de invitados previos al final de esta página
"Propiedades físicas, químicas y biológicas del agregado de trióxido mineral y del cemento de portland" por Katherine Blohm Lichaa Trabajo de grado presentado ante la ilustre Universidad Central de Venezuela para optar al titulo de Especialista en Endodoncia.
INTRODUCCIÓN Los materiales odontológicos han sido parte importante en la evolución de la odontología y gracias a los grandes adelantos tecnológicos y bioquímicos, se ha logrado una generación de nuevos materiales con mejores propiedades físicas, químicas y biológicas. Sin embargo, un avance que surgió en el área de la Endodoncia suscitó una gran revolución dentro de la Odontología. En el inicio de los años 90, Mahmoud Torabinejad, hizo la presentación del Agregado de Trióxido Mineral (MTA) como un material experimental, creando expectativas respecto a su uso en Endodoncia. En 1993, se publicó el primer trabajo científico utilizando el MTA. Los autores inicialmente recomendaron su utilización como material para el sellado de comunicaciones entre el sistema de conductos radiculares y los tejidos periapicales y para obturar el extremo apical en la cirugía perirradicular. Posterior a ello, se han realizado una serie de estudios, tanto in Vitro como in Vivo, todos con el propósito de evaluar el comportamiento físico, químico y biológico del MTA como material de obturación del extremo apical. En ellos queda demostrado que el MTA es superior a los otros materiales empleados con el mismo propósito, como los son la amalgama, IRM® y el SuperEBA®. En la actualidad, se ha extendido su utilización en la terapia endodóntica a otras aplicaciones clínicas. Se le considera un excelente material para el sellado de perforaciones resultantes de resorciones internas y externas, además, en los dientes con ápices inmaduros, funciona exitosamente, tanto para preservar vital el tejido pulpar radicular, como en la apicoformación, para lograr una barrera apical que permita la obturación. Debido a la naturaleza de las partículas hidrofílicas del polvo del MTA y su biocompatibilidad, puede emplearse en condiciones de humedad, razón por la cual es ampliamente utilizando en Endodoncia. Recientemente, se ha comparado el MTA con el Cemento de Portland (PC), los resultados sugieren que ambos materiales tienen elementos en común en su composición como el calcio, fosfato, sílice, además, de propiedades macroscópicas y microscópicas similares. Sin embargo, el MTA es de un costo mayor al PC. Tomando en cuenta la similitud de las propiedades entre ambos cementos, MTA y PC, sería razonable considerar al PC como sustituto del MTA en la clínica endodóntica. El objetivo general de este trabajo especial de grado es analizar las diferentes propiedades físicas, químicas y biológicas del Agregado de Trióxido Minera así como sus diferentes aplicaciones clínicas en Endodoncia y su comparación con el Cemento de Pórtland.
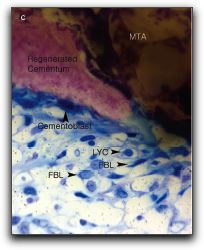
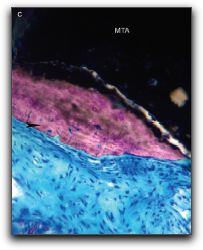
REVISIÓN DE LA LITERATURA ANTECEDENTES DEL AGREGADO DE TRIÓXIDO MINERAL Y DEL CEMENTO DE PORTLAND 1.1.- Generalidades del Agregado Trióxido Mineral El Agregado de Trióxido Mineral (MTA) fue desarrollado en 1993 en la Universidad de Loma Linda &endash; California, Estados Unidos (1), recibiendo la aprobación por la Administración de Drogas y Alimentos de Estados Unidos en 1998. (2) Fue introducido en Endodoncia para el sellado de perforaciones radiculares. (1) Posteriormente, se recomendó para ser utilizado en cirugía endodóntica como material de obturación del extremo apical. (3), (4) También ha sido empleado en la terapia de pulpas vitales como recubridor pulpar directo y como barrera apical en el tratamiento de dientes inmaduros con pulpas no vitales y ápices abiertos. (5) Además, puede utilizarse como material de obturación provisional, y como material intermedio después de la obturación del sistema de conductos radiculares, entre la gutapercha y el material de restauración provisional ya que proporciona un sellado eficaz contra la penetración de bacterias y sus productos. (6) Diversos estudios han demostrado que el MTA es más biocompatible y menos citotóxico que otros materiales utilizados en aplicaciones clínicas similares como la amalgama, gutapercha, cemento de óxido de zinc y eugenol, cemento de óxido de zinc mejorado, hidróxido de calcio, ionómero de vidrio, entre otros. (7) También ha mostrado ser superior en términos de capacidad de regeneración de los tejidos perirradiculares. (8) Igualmente, presenta propiedades antimicrobianas, radiopacidad, estabilidad dimensional y tolerancia a la humedad. (9) 1.1.1.- Tipos de Agregado de Trióxido Mineral El MTA es un derivado del PC, ambos de color gris y blanco. Se fabrican con materias primas similares, a excepción de un agente fluido que se utiliza para la producción de la versión en blanco para eliminar la fase férrica durante una etapa del proceso llamada clinca. (10) Además del MTA (Loma Linda University, Loma Linda CA), actualmente, se disponen de 3 marcas comerciales de MTA: ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) en 2 presentaciones, una de color gris, introducido en 1998 y otro de color blanco introducido en el año 2002; el MTA Angelus® (Angelus Soluçöes Odontológicas, Londrina, Brazil) en 2 presentaciones, de color gris y blanco introducido en el año 2001, (11), (12), Gráficos Nº 1, 2, 3 y 4.  
Y más recientemente, en el 2004, fue desarrollado en Argentina el CPMTM (Egeo S.R.L., Buenos Aires, Argentina). (13) 1.1.2.- Composición química del Agregado de Trióxido Mineral Gris El MTA es un polvo que contiene finas partículas hidrofílicas que forman un gel coloidal en presencia de agua que solidifica a una estructura dura aproximadamente en 4 horas. (5) Según Torabinejad et al. (4) las principales moléculas presentes en el MTA gris (Loma Linda University, Loma Linda CA) son los iones de calcio y fósforo. Según los autores, como estos iones también son los principales componentes de los tejidos dentarios, le proporcionan al MTA excelente biocompatibilidad cuando está en contacto con las células y los tejidos. Los análisis realizados demostraron que el MTA después de su endurecimiento, se constituye de óxido de calcio (CaO) en forma de pequeños cristales y de fosfato de calcio con una estructura amorfa con apariencia granular. La composición promedio de los prismas es: 87% de calcio, 2,47% de sílice y el resto es de oxígeno, mientras que las áreas de la estructura amorfa contienen 33% de calcio, 49% de fosfato, 2% de carbono, 35% de cloruro y 6% de sílice. Los principales componentes presentes en este material son el silicato tricálcico (3CaO-SiO2), aluminato tricálcico (3CaO-Al2O3), óxido tricálcico y óxido de silicato. Mediante ensayos químicos y de difracción de rayos X, Herzog-Flores et al. (14), analizaron la composición físico-química del MTA gris (Loma Linda University, Loma Linda CA), mostrando que el 18% es insoluble en agua, el 0,36% correspondería al MgO y el 90% de CaO, siendo el 80% de su estructura cristalina. El ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK), se observa como un polvo gris, compuesto principalmente por un 75% de silicato tricálcico (3CaO-SiO2), silicato dicálcico (2CaO-SiO2), aluminato tricálcico (3CaO-Al2O3), ferroaluminato tetracálcico (4CaO-Al2O3-Fe2O3) respectivamente, así como un 20% de óxido de bismuto (Bi2O3), principal responsable de la radiopacidad del material (4) y 5% de sulfato de calcio dihidratado (CaSO4-2H2O). Según el fabricante, puede contener también hasta el 0,6% de residuos insolubles libres como el sílice cristalino y otros elementos libres como el óxido de calcio (CaO), y el óxido de magnesio (MgO), además de álcalis (Na2O y K2O) bajo la forma de sulfatos. (10) El Bi2O3 es un material químicamente inerte que cuando es añadido al PC es conocido como MTA. (4) Recientemente, el fabricante del ProRoot MTA® (Dentsply Tulsa Dental, Tulsa, OK) describió que el material está compuesto por 75% de PC, 20% de Bi2O3 y 5% de CaSO4-2H2O. (12) De acuerdo con el fabricante, el MTA Angelus® en sus 2 presentaciones (Angelus Soluçöes Odontológicas, Londrina, Brazil) contiene en su composición óxido de silicio (SiO2), óxido de potasio (K2O), óxido de aluminio ( Al2O3), óxido de sodio (Na2O), óxido de hierro (Fe2O3), ácido sulfúrico (SO3), CaO, Bi2O3, MgO y residuos insolubles de sílice cristalina, CaO y sulfatos de potasio y sodio. Está constituido por un 80% de PC y 20% de Bi2O3. No posee en su fórmula CaSO4, con la finalidad de reducir el tiempo de gelificación, el cual ocurre en 10 minutos. Cuando no se coloca este componente, se forma hidrato de aluminato espático, que no forma puente entre las partículas de cemento, lo que produce un rápido endurecimiento. (15) El CPMTM (Egeo S.R.L., Buenos Aires, Argentina) es también un MTA para uso clínico, similar al MTA. El polvo también está compuesto por finas partículas hidrofílicas que forman un gel coloidal en presencia de humedad y solidifica a una estructura dura en 1 hora. Los principales componentes son el 3CaO-SiO2, 3CaO-Al2O3 y el óxido tricálcico. (13) 1.1.3.- Composición química del Agregado de Trióxido Mineral Blanco Recientemente, el MTA blanco se ha desarrollado y comercializado para sustituir el MTA gris cuando existe un compromiso estético, debido a que la presentación gris era propenso a pigmentar la estructura dentaria, por lo que en su contenido se observa una reducción significativa en la proporción del componente 4CaO-Al2O3-Fe2O3. (11) Una serie de estudios se han realizado con esta presentación para determinar si presenta las mismas propiedades que el MTA gris. Los estudios comparativos entre ambos, han dado resultados contradictorios en términos de biocompatibilidad, capacidad de sellado y la propiedad de inducir la regeneración de los tejidos. (16) En este sentido, Asgary et al. (17) analizaron y compararon los elementos constitutivos del ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) blanco y del ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) gris. El análisis de los resultados mostró que los óxidos predominantes en ambos tipos de MTA son el calcio, sílice y Bi2O3 respectivamente (73% en el gris y 82% en el blanco). Las mayores diferencias se encontraron en las concentraciones de trióxido de aluminio, MgO y especialmente en el Fe2O3, siendo la concentración de estos considerablemente menores en el MTA blanco. Los autores hacen referencia, que la mayoría de los elementos transcisionales como el cromo, magnesio, hierro y cobre, contienen electrones libres (relacionados con la adhesión), que son los que exhiben colores oscuros cuando forman óxidos. Todos estos elementos están presentes en el MTA gris. Por lo que la ausencia significativa de óxido de hierro en el MTA blanco es la causa principal de su color. En un estudio similar, Camilleri et al. (18) determinaron la constitución de las dos presentaciones del MTA; ProRoot® MTA gris y blanco (Dentsply Tulsa Dental, Tulsa, OK) antes y después de la mezcla con agua. Los materiales fueron analizados utilizando energía dispersa por medio de rayos X (EDAX) y microscopio electrónico de barrido mediante difracción de rayos X (XRD). Los resultados demostraron mediante el EDAX, que el MTA blanco está compuesto principalmente por calcio, sílice, bismuto y oxígeno, mientras que el MTA gris está compuesto por calcio, sílice, aluminio, hierro, bismuto y oxígeno, siendo el calcio y el sílice los elementos más predominantes. El análisis mediante el XRD, mostró que el MTA blanco está compuesto principalmente por 3CaO-SiO2 y Bi2O3, mientras que el MTA gris está compuesto principalmente por 3CaO-SiO2, 2CaO-SiO2 y Bi2O3. Los autores mencionan, que el MTA blanco no contiene entre sus componentes el hierro, no engloba las grandes partículas del MTA gris, que son importantes para el manejo de sus propiedades clínicas. 1.2.- Generalidades del Cemento de Portland El nombre técnico del Cemento de Portland fue creado por Joseph Aspdin, constructor y químico británico, quien el 21 de Octubre de 1824 patentó el primer proceso de fabricación del cemento, al que llamo de Portland, en razón de las semejanzas de color y dureza que tenía su invento con las piedras que se encuentran en la isla de Portland en Inglaterra. (19) La fabricación del cemento se da en tres fases: preparación de la mezcla de la materia prima, producción de la clinca y preparación del cemento. La materia prima para la producción del PC son minerales que contienen 44% de CaO, 14,5% de óxido de silicio (SiO), 3,5% de óxido de aluminio (Al2O3), 3% de óxido de hierro (Fe2O3), 1,6% de MgO. Una vez calentada la mezcla, el material resultante es denominado clinca. Para mejorar las características del producto final se le agrega 2% de CaSO4, la mezcla es molida y el polvo obtenido es el cemento preparado para su uso. (20) El cemento obtenido tiene en su composición 64% de CaO, 21% de SiO, 5,5% de Al2O3, 4,5% de Fe2O3, 2,4% de MgO, 1,6% de sulfatos y 1% de otros materiales entre los cuales principalmente agua. (20) Los minerales más importantes que contiene el PC son el 3CaO-SiO2, 2CaO-SiO2, 3CaO-Al2O3, 4CaO-Al2O3-Fe2O3 y CaSO4. Siendo éste último un determinante importante en el tiempo de endurecimiento, al igual que el 4CaO-Al2O3-Fe2O3 aunque en menor medida. (21) No obstante, Estrela et al. (22) evaluaron las propiedades químicas de algunos materiales entre ellos el PC (Cia. Portland Cement Itaú, Itaú de Minas, MG, Brazil) y el ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK). Observaron que el PC contiene los mismos elementos químicos que el MTA, a excepción del Bi2O3 presente en el MTA, el cual se le agrega para darle la radiopacidad adecuada al material. Este mismo hecho fue confirmado por Funteas et al. (23) en un análisis comparativo, donde observaron que no hay diferencias significativas entre los 14 elementos presentes en el PC y el MTA, corroborando la ausencia del Bi2O3 en el PC. Al igual que Camilleri et al. (18), demostraron en su estudio, que los componentes del del PC común son similares a los del ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) en sus 2 presentaciones, por lo que se espera que las reacciones también sean similares. Por otro lado, Abdullah et al. (24) observaron en su estudio que las características superficiales del PC común, sin modificaciones y del MTA gris (Loma Linda University, Loma Linda, CA.) son irregulares, consistiendo en pequeños cristales irregulares, haciéndolos un material granular con apariencia de coral cuando es visto bajo magnificación. Song et al. (16) evaluaron la composición química y estructura cristalina del PC, ProRoot® MTA gris y blanco (Dentsply Tulsa Dental, Tulsa, OK), y MTA Angelus® gris (Angelus Soluçöes Odontológicas, Londrina, Brazil) utilizando energía dispersa de rayos X mediante un sistema de espectómetro para determinar la composición de los materiales a prueba, y difracción de rayos X de para analizar la estructura cristalina de los mismos. Mostraron que el PC no contiene Bi2O3 y tiene óxido de potasio. El MTA Angelus® gris tenía menor cantidad de Bi2O3 que el ProRoot® MTA. También observaron que la estructura cristalina y la composición química del ProRoot® MTA blanco y gris fueron similares, con la única excepción que el MTA gris contenía una cantidad mayor de hierro al ser comparado con el MTA blanco, teniendo como principales compuestos Bi2O3 y 2CaO-SiO2. De acuerdo con estos autores, no se encontraron diferencias significativas en cuanto a la composición y estructura cristalina para cada uno de los materiales evaluados en este estudio. Sin embargo; es importante hacer énfasis que ambos materiales no son idénticos. Los componentes del MTA tienen un menor tamaño de la partícula, contienen menos metales pesados tóxicos, posee un mayor tiempo de trabajo y parece haber sufrido un proceso adicional de purificación que el PC común. (24), (25) Además, la fabricación industrial del PC no está aprobada actualmente para su utilización en los Estados Unidos, y por lo tanto no se puede recomendar su uso clínico en seres humanos. Se deben llevar a cabo estudios in Vitro e in Vivo, especialmente en cuanto a su biocompatibilidad, para determinar si cumple con los requisitos establecidos por la Federación Dental Americana (FDA) para su uso como material odontológico. (25)
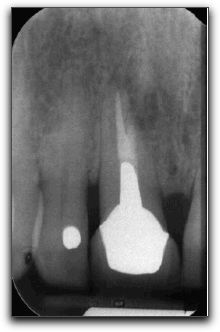
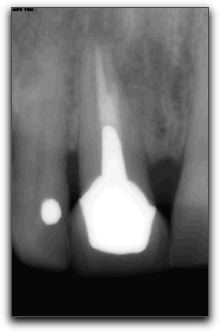
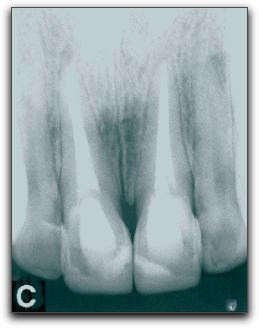
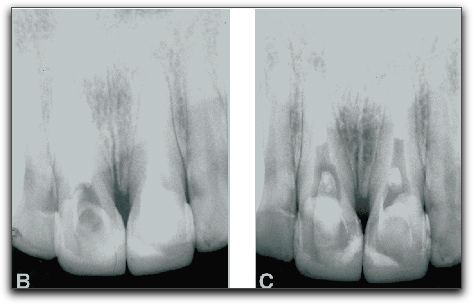
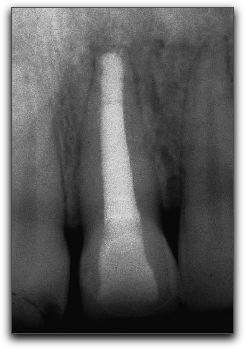
2.- PROPIEDADES FÍSICAS Y QUÍMICAS DEL AGREGADO DE TRIÓXIDO MINERAL Y DEL CEMENTO DE PORTLAND 2.1.- Análisis del pH Torabinejad et al. (4) estudiaron las propiedades físicas del MTA (Loma Linda University, Loma Linda, CA) y las compararon con la amalgama, IRM®, y SuperEBA®. El pH del MTA fue de 10.2 posteriormente a su hidratación con agua destilada. Sin embargo, 3 horas después, ese valor subió a 12.5 permaneciendo estable. Mientras Weidmann et al. (26) observaron que el pH del PC aumenta considerablemente durante el primer minuto después de su hidratación, alcanza el valor de 12.3 y continúa aumentando hasta un valor máximo de 12.9 después de 3 horas. Por su parte, Islam et al. (25) evaluaron el pH del ProRoot® MTA gris y blanco (Dentsply Tulsa Dental, Tulsa, OK), PC común (Asia Cements Pte. Ltd., Singapore), y PC blanco (Asia Cements Pte. Ltd.). Las medidas fueron tomadas cada 2 minutos desde el inicio de la mezcla hasta los 60 minutos. Los resultados indicaron que el pH del PC blanco (pH 13) y el PC común (pH 12,9) fue mayor que las 2 presentaciones de MTA. Ambas formas del PC alcanzaron los valores máximos de pH antes que el MTA blanco y gris, cuyos valores fueron 12.8 y 12.7 respectivamente. Por otro lado, Wiltbank et al. (27) determinaron el pH del PC, ProRoot® MTA gris y blanco (Dentsply Tulsa Dental, Tulsa, OK), mezclándolos con 3 aceleradores diferentes: cloruro de calcio (CaCl2), nitrato de calcio (CN) y formato de calcio (CF). Los valores del pH fueron registrados inmediatamente después de la mezcla y luego a 1, 5 y 10 minutos. El valor máximo de pH fue registrado al momento de iniciar la mezcla. El CaCl2 no produjo cambios significativos en los materiales estudiados, el CN disminuyó significativamente el pH del MTA gris y del PC y el CF aumento significativamente los valores del MTA blanco. Los resultados demostraron que al agregarle el CN disminuyó el pH del MTA gris y del PC de manera estadísticamente significativa, sin embargo; estos cambios son aceptables clínicamente. 2.2.- Radiopacidad El MTA posee entre sus componentes 20% de Bi2O3, el cual le confiere la propiedad de ser más radiopaco que la dentina (0,70 mm) y la gutapercha (6,14 mm), siendo fácilmente distinguible en las radiografías. La medida de radiopacidad del MTA (Loma Linda University, Loma Linda, CA) es de 7,17 mm equivalente al espesor del aluminio. (4) Con respecto al PC, entre su composición no contiene Bi2O3, por lo que radiográficamente es poco visible, teniendo una radiopacidad semejante a la de la dentina. (22), (23) Islam et al. (25) en su estudio determinaron que la radiopacidad del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK) es de 6,74 mm y para el ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK) es de 6,47 mm. El PC común (Asia Cements Pte. Ltd., Singapore), y el PC blanco (Asia Cements Pte. Ltd.) mostraron ser menos radiopacos. El PC en su estado natural es ligeramente radiopaco, pero no cumple con el requisito mínimo de radiopacidad establecido en la norma ISO 6876: 2001. Representando una desventaja importante en caso de ser utilizado clínicamente. (25) El PC natural a pesar de que carece de la radiopacidad radiográfica necesaria para realizar el seguimiento y evaluación postoperatoria del procedimiento endodóntico (28), se ha propuesto como una alternativa del MTA. (24), (29) 2.3.- Tiempo de endurecimiento El proceso de endurecimiento es producto de la hidratación de la reacción del 3CaO-SiO2 y 2CaO-SiO2, siendo este último el responsable del desarrollo de la fuerza del material. (30) Como resultado de la hidratación del polvo del MTA, se forma un gel coloidal que se solidifica en menos de 3 horas en una estructura dura y resistente. (3) El MTA posee aproximadamente la mitad del contenido de CaSO4 que presenta el PC, así como también pequeñas cantidades de aluminio, proporcionándole al MTA un mayor tiempo de endurecimiento que al PC (24), siendo el CaSO4 un elemento importante en el tiempo de endurecimiento. (21) EL MTA Angelus® (Angelus Soluçöes Odontológicas, Londrina, Brazil) en sus 2 presentaciones no presenta entre sus componentes el CaSO4, hecho que le confiere la propiedad de endurecerse a los 10 minutos aproximadamente. (15) Por otro lado, Torabinejad et al. (3) en su estudio señalaron que el MTA gris (Loma Linda University, Loma Linda, CA) mostró el mayor tiempo de endurecimiento, 2 horas y 30 minutos, en comparación con la amalgama que es de 4 minutos. Posteriormente, en 1995, un estudio similar realizado por Torabinejad et al. (4) determinaron que el tiempo de endurecimiento del MTA era de 2 horas 45 minutos (+ 5 minutos). Mientras que, Abdullah et al. (24) considerando que el tiempo de endurecimiento prolongado es la principal desventaja del MTA, le agregaron CaCl2 al PC, material base del MTA, para acelerar su endurecimiento, y para observar si se producirían modificaciones respecto a su comportamiento químico, físico y biológico. Esa adición se realizó en el PC para producir dos variaciones del mismo, uno con el 10% y el otro con el 15% de CaCl2. Para hacer la comparación, se utilizó un PC común, un cemento de ionómero de vidrio y el ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK). Observaron que la adición del CaCl2 disminuyó el tiempo de endurecimiento y no alteró la forma de los cristales cuando se compararon con las que se encuentran en el PC común. Esta observación demostró que el CaCl2 no interfiere en la composición química del PC original, cuyos principales componentes son los iones de calcio y fósforo. Adicionalmente, Dammaschke et al. (30) evaluaron el mecanismo de endurecimiento del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK) mediante el uso de rayos X y espectroscopía. Reportaron que la superficie de los elementos de azufre y potasio aumentaron 3 veces durante la reacción. Sugirieron que el tiempo de endurecimiento del MTA puede prolongarse por la formación de una capa de trisulfatos, que puede servir para evitar una mayor hidratación de la reacción. Para reducir el tiempo de endurecimiento se han utilizado aceleradores en la fase líquida, ya que el líquido es necesario para el endurecimiento del polvo. (27) Wiltbank et al. (27) evaluaron el tiempo inicial de endurecimiento del PC, ProRoot® MTA gris y blanco (Dentsply Tulsa Dental, Tulsa, OK), mezclándolos con 3 aceleradores diferentes: CaCl2, nitrato de calcio (CN) y formato de calcio (FC). Encontraron que al agregarle 5% de CaCl2 el tiempo inicial de endurecimiento fue de 35 minutos para todos los materiales. Cuando se utilizó el CN el tiempo para el PC y el MTA gris fue de 7.3 y 7.0 minutos respectivamente y el FC aceleró significativamente el tiempo inicial de endurecimiento de los 3 cementos a los siguientes niveles: PC 9.0 minutos, MTA blanco 6.0 minutos y MTA gris 8.7 minutos. El uso de una menor concentración o de menores cantidades de los aceleradores podría ofrecer la ventaja de producir un menor cambio en las propiedades físicas de los materiales y un tiempo de endurecimiento más lento. Un ajuste del tiempo menor a los 10 minutos como se reportó en este estudio, podía ser demasiado rápido para determinados procedimientos tales como la colocación de una barrera apical. Por otro lado, un tiempo de endurecimiento más rápido, podría ser conveniente para el sellado de perforaciones y obturación del extremo apical. (27) Así mismo, Huang et al. (31) evaluaron el efecto acelerador del fosfato dibásico de sodio (Na2HPO4) sobre las propiedades del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK). Además, utilizaron otros líquidos diferentes, como agua, cloruro de sodio, hidróxido de calcio, entre otros. Demostraron que la reducción máxima del tiempo fue con el Na2HPO4, logrando un tiempo de endurecimiento a los 33 minutos. Por otro lado, Islam et al. (25) compararon el tiempo de endurecimiento del ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK), ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK), PC común (Asia Cements Pte. Ltd., Singapore), y PC blanco (Asia Cements Pte. Ltd.) sin la adición de aceleradores. Demostraron que el PC blanco y el MTA blanco tienen un tiempo de endurecimiento significativamente más rápido que el PC gris y el MTA gris. Aunque el ProRoot® MTA gris y blanco muestren una diferencia significativa en el tiempo de endurecimiento, es poco probable que sea clínicamente importante cuando son utilizados como materiales para sellar el extremo apical. Los resultados demostraron que el tiempo de endurecimiento del ProRoot® MTA gris fue similar al del PC común; mientras que el del ProRoot® MTA blanco fue similar al del PC blanco. Esto sugiere que el MTA blanco puede contener al PC blanco como material de base. Si bien el prolongado tiempo de endurecimiento del MTA le impide ser utilizado como material de protección temporal, se ha sugerido que el PC con la adición de aceleradores, puede ser utilizado como material de restauración. Para Kogan et al. (32) el efecto de mezclar el polvo del MTA con diferentes líquidos y aditivos ha demostrado que la preparación puede tener efecto sobre el tiempo de endurecimiento y la fuerza compresiva del material. Utilizar 5% de CaCl2 disminuye el endurecimiento del ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK) a 20 25 minutos, pero la fuerza compresiva es significativamente menor que la que se obtiene con agua estéril. Cuando se utiliza solución salina y lidocaína al 2% se incrementa el tiempo de endurecimiento, pero la fuerza compresiva no es afectada. Cuando se le agrega al MTA gluconato de clorhexidina (CHX) en gel al 2% no ocurren cambios el endurecimiento. El clínico puede considerar diferentes soluciones en lugar de agua estéril, sin embargo, debe tener en cuenta el potencial terapéutico y la ganancia o pérdida de las propiedades físicas del material. (33) 2.4.- Proporción polvo-líquido De acuerdo con Torabinejad y Chivian (5) el MTA debe prepararse inmediatamente antes de su utilización. El polvo se mezcla con agua destilada esterilizada en la proporción de 3:1 sobre una loseta de vidrio o papel espatulándolo durante 30 segundos, con una espátula de plástico o metal, hasta que adquiera una consistencia arenosa. Así mismo, los autores recomiendan que si el área de aplicación del MTA fuese muy húmeda, esa humedad extra puede ser removida con una gasa seca o goma espuma. La presencia de humedad no sólo deja el material muy acuoso, sino también difícil de manipular. Cuando la mezcla es muy seca, se debe adicionar más agua. En función de que el MTA necesita humedad para gelificar, al dejar la mezcla sobre la loseta, se producirá su hidratación, que le proporciona un aspecto de mezcla arenosa, por lo que se recomienda colocar una gasa húmeda sobre la pasta de MTA. En este sentido, la cantidad de agua destilada utilizada para la reacción de hidratación del MTA o del PC puede influir sobre sus propiedades químicas, físicas y biológicas. La tensión superficial del agua es alta, la hidratación de las partículas del polvo puede ocurrir de forma no homogénea, y las partículas pueden permanecer sin hidratarse, lo que perjudica algunas propiedades de los materiales. De esta forma, la utilización de un líquido o de una solución con menor tensión superficial, además de proporcionar una mejor acción humectante, también proporcionará una mejor plasticidad, mejorando las condiciones de trabajo. Aunque también puede causar alteración en el tiempo de gelificación. (34) 2.5.- Hidratación La hidratación del polvo del MTA con agua destilada resulta en un gel coloidal que se solidifica en una estructura dura. La naturaleza hidrofílica de las partículas del polvo le proporciona una característica especial, pudiendo utilizarse en presencia de humedad, como sucede en los procedimientos clínicos en casos de perforaciones y en la obturación del extremo apical, sin necesidad de un campo seco. En estas situaciones la humedad presente en los tejidos actúa como un activador de la reacción química de este material. (3) Adicionalmente, Torabinejad et al. (35) manifiesta que la capacidad de sellado que muestra el MTA probablemente se debe a su naturaleza hidrofílica y a la leve expansión cuando es manipulado en un ambiente húmedo. La reacción que se produce durante la hidratación de los cementos de MTA y PC es exotérmica, y el aumento de la tasa de hidratación puede aumentar la tasa de generación de calor. La adición de aceleradores puede también aumentar el calor liberado por la reacción. (36) 2.6.- Solubilidad Cuando se colocan materiales para la obturación del extremo apical, la pérdida de peso del material (solubilidad) puede estar influenciada por las alteraciones del pH y la osmolaridad del medio, por el tiempo transcurrido después de su espatulado y subsiguiente contacto con los fluidos del tejido. El contacto inicial del material con el coágulo sanguíneo o con la humedad puede tener un efecto adverso sobre la solubilidad del material. Un cemento puede perder hasta el 1,5% del peso después de inmerso por 24 horas en agua destilada. (37) Torabinejad et al. (4) determinaron en su estudio la solubilidad del IRM®, amalgama, SuperEBA® y MTA (Loma Linda University, Loma Linda, CA). Los materiales se prepararon de acuerdo con las instrucciones del fabricante. Se colocaron en 6 discos a 100% de humedad por 21 horas, y se almacenaron cada uno en botellas de vidrio que contenían 50ml de agua destilada a 37ºC para posteriormente disecarlos. Los procesos de disecación y de peso se realizaron a 1, 7 y 21 días respectivamente. No hubo cambios significativos para la amalgama, SuperEBA® y MTA cuando la media de los pesos de los especímenes se comparó en diferentes intervalos de tiempo, sin embargo para el IRM® si se observaron diferencias estadísticamente significativas en diferentes intervalos de tiempo. Los resultados demostraron que la amalgama, el SuperEBA® y el MTA no presentaron signos de solubilidad en agua después de 21 días. Por otro lado, Herzog-Flores et al. (14) realizaron un estudio para determinar la composición físico-química del MTA (Loma Linda University, Loma Linda, CA). Utilizaron ensayos químicos analíticos para determinar los principales óxidos presentes en el material y por medio de difracción de rayos X, determinaron la composición química del mismo. El análisis de las muestras determinó que el 18% del material es insoluble en agua, mientras que el 0,36% corresponde al MgO y 90% al CaO. La informacion que el fabricante del ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) suministra es que aproximadamente el 20% del peso del material corresponde al Bi2O3, que es insoluble y presenta alto peso molecular, que corresponde entre el 15% y 17% del volumen del material. Además del Bi2O3, el ProRoot® MTA contiene hasta el 0,6% de residuos insolubles libres como la sílice cristalina y determinados argilominerales. (12) De acuerdo con el fabricante del ProRoot® MTA la solubilidad del material en agua está comprendida entre 0,1% y 1,0%, considerándose ligeramente soluble. (12) Según Material Safety Data Sheet (MSDS) de industrias productoras del PC, se constata que presenta una solubilidad comprendida entre 0,1% y 1,0%, lo que evidencia la similitud de solubilidad entre ambos materiales. (34) Igualmente, los sulfatos de calcio hemihidratado y dihidratado que componen el MTA presentan ligera solubilidad en agua (0,3 g/l a 25ºC y 0,26 g/l a 25ºC, respectivamente) siendo el Bi2O3 insoluble. (12) Sin embargo, Fridland y Rosado (38) en su estudio determinaron la solubilidad y porosidad del ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) cuando es mezclado a diferentes proporciones de agua y polvo y establecieron la composición química de las sales disueltas a partir de la mezcla. Utilizaron 4 proporciones diferentes: 0,26, 0,28, 0.30 y 0,33 gramos de agua por gramo de cemento. Éste último es la medida recomendada por el fabricante. Demostraron que la solubilidad aumenta de manera significativa cuando se incrementa la proporción de agua polvo en el ProRoot® MTA. Los valores de solubilidad para las proporciones 0,26, 0,28, 0.30 y 0,33 fueron 1,76, 2,25, 2,57 y 2,83 respectivamente. La cantidad de agua utilizada en la preparación de la mezcla tiene un efecto directo sobre la solubilidad cuando el material está en contacto con un medio ambiente acuoso. El MTA (Loma Linda University, Loma Linda, CA, USA) es el precursor del ProRoot MTA® y no fue fabricado por la Dentsply Tulsa Dental. Es posible que una modificación en el proceso de fabricación sea la causa de la diferencia de solubilidad. (38) De igual manera, Islam et al. (25) en su estudio determinaron, que la solubilidad del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK) fue de 1,28 siendo significativamente mayor que el ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK) cuyo valor fue de 0,97 y PC común (Asia Cements Pte. Ltd., Singapore) y PC blanco (Asia Cements Pte. Ltd.), con valores de 1,06 y 1,05 respectivamente. Si bien no encontraron diferencias significativas en la solubilidad del PC común y el PC blanco, ambos mostraron una mayor solubilidad que el MTA gris. Sin embargo, todos los valores están dentro de los requisitos ISO para la solubilidad de los materiales de sellado del conducto radicular. 2.7.- Resistencia compresiva La resistencia compresiva es un factor importante a considerar cuando se coloca el material de obturación en una cavidad que soporta cargas oclusales. Debido a que los materiales de obturación apical no soportan una presión directa, la resistencia compresiva de estos materiales no es tan importante, como la de los materiales utilizados para reparar defectos en la superficie oclusal. (4) En este sentido, Torabinejad et al. (4) determinaron la resistencia compresiva del MTA (Loma Linda University, Loma Linda, CA), amalgama, IRM® y SuperEBA®. Se mezcló cada material y se colocó en un molde de acero inoxidable. Se prepararon 6 muestras para cada material en estudio, fueron sumergidas en agua destilada con diversos intervalos de tiempo que oscilaron entre 21 horas y 3 semanas. Se midió la resistencia compresiva utilizando una máquina de prueba de Instrôn, la fuerza fue aplicada siguiendo el eje largo de la muestra. Los resultados demostraron que el MTA presentó en los tiempos iniciales valores menores, que aumentaron considerablemente con el transcurso del tiempo. A los 21 días después de su manipulación, el valor de la fuerza compresiva del MTA que era de alrededor de 40 megapascal (MPa), subió a 67 MPa, comparable a la del IRM® y a la del SuperEBA®, pero significativamente menor que la de la amalgama de plata que es de 311 MPa. En este estudio se encontró un incremento en la fuerza compresiva del MTA, después que el material fue colocado bajo condiciones de humedad durante 3 semanas, asumiendo que bajo estas condiciones, la hidratación adicional del MTA puede incrementar la fuerza compresiva y disminuir la microfiltración. En efecto, Sluyk et al. (39) evaluaron las características de retención del MTA (Loma Linda University, Loma Linda, CA) cuando se utiliza como material de sellado de perforaciones de furca. Emplearon 32 dientes humanos extraídos multirradiculares superiores e inferiores. Se realizaron las perforaciones en el centro del piso cameral, paralelo al eje longitudinal del diente con una fresa número 2 de carburo. El diámetro de las perforaciones fue de 1,4 mm. Se colocó debajo de cada una de las perforaciones goma espuma humedecida con solución salina para simular la condición clínica. Los dientes fueron divididos aleatoriamente en 4 grupos y las perforaciones fueron selladas con MTA. Fueron cubiertas con una bola pequeña de algodón húmedo y seco durante 24 y 72 horas. La prueba de Instrôn se utilizó para medir la fuerza necesaria para desplazar el material de la perforación. Los autores concluyeron que el MTA resistió al desplazamiento en un grado significativamente mayor, en 72 horas que en 24 horas y que, cuando un ligero desplazamiento se produjo en el período de 24 horas, el material demostró capacidad para restablecer la resistencia al desplazamiento de las paredes dentinarias. La presencia de humedad después del sellado significó una mejora en la adaptación del MTA a las paredes de la perforación, no obstante no hubo diferencias significativas en la retención del MTA cuando se colocaron torundas secas y húmedas de algodón en la cámara pulpar durante el período experimental. Por otro lado, Coomaraswamy et al. (40) evaluaron el efecto del Bi2O3 sobre las propiedades del PC (Blue Circle Mastercrete; LaFarge, Chilton, UK), como material base del ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK). Encontraron que hay una disminución de la resistencia mecánica de 82MPa a 40MPa cuando aumenta el contenido de Bi2O3 del 0% al 10%, disminuyendo gradualmente a 29MPa al aumentar el contenido de Bi2O3 al 40%. También observaron que al aumentar gradualmente el contenido del óxido también hay un incremento en la porosidad del material. Este aumento en la porosidad del material, produce un incremento en la solubilidad, y por lo tanto la desintegración del material. Este hecho, podría afectar potencialmente la longevidad del material y por ende la capacidad de sellado, en comparación con la del PC puro. (40) Así mismo, Holt et al. (41) realizaron un estudio in Vitro para comparar la fuerza compresiva del MTA gris (Dentsply Tulsa Dental, Tulsa, OK) mezclándolo con agua estéril o CHX al 2%. Se impregnaron bolas de MTA durante 72 horas y luego se midió la fractura. Posteriormente, los valores fueron registrados y comparados. Los resultados indicaron que el MTA mezclado con agua estéril tuvo una mayor fuerza compresiva que al mezclarlo con CHX al 2%. El uso del MTA mezclado con CHX al 2% sólo puede ser recomendado en zonas expuestas a un mínimo de fuerza compresiva hasta que no se presenten pruebas que garanticen que la CHX no ejerce un efecto biológico negativo sobre los tejidos circundantes. (41) 2.8.- Sellado marginal El éxito de un material endodóntico va a depender en gran medida de su capacidad de sellado, previniendo la microfiltración de bacterias y endotoxinas.(42) En este sentido, el estudio de la microfiltración del MTA y otros materiales endodónticos, constituye un aspecto crítico a evaluar, ya que la humedad puede ser un factor importante debido a su efecto sobre las propiedades físicas y la calidad del sellado de los materiales restauradores. (43) Es por ello, que Torabinejad et al. (43) compararon la cantidad de filtración de colorante en presencia y ausencia de sangre del MTA (Loma Linda University, Loma Linda, CA , IRM®, amalgama y SuperEBA®. Utilizaron 90 dientes extraídos humanos, a los cuales se les eliminó la corona clínica, se instrumentaron con la técnica telescópica y fueron obturadas con gutapercha y sellador. Posteriormente se removieron 3 mm del ápice de cada diente con una fresa cilíndrica, se preparó una cavidad de 1 mm de diámetro y 2 mm de profundidad. Fueron obturados 5 ápices con gutapercha y no se sellaron, y otros 5 se obturaron con cera pegostosa, sirviendo éstos como controles positivos y negativos respectivamente. Se dividieron 80 raíces en 4 grupos iguales para cada material. De cada grupo, la mitad de las cavidades fueron contaminadas con sangre y la otra mitad secada antes de recibir cada uno de los materiales en estudio. A todas las raíces se les colocó azul de metileno al 1% por 72 horas. Posteriormente se seccionaron las raíces y se midió la penetración del colorante. Los resultados arrojaron que la filtración del MTA fue significativamente menor con respecto a los otros materiales, tanto en presencia como en ausencia de sangre. Demostró excelente capacidad de sellado, la microfiltración marginal que se produjo en la interfaz material/pared dentinaria fue mínima. Es evidente que cuando un material de obturación no permite el paso de moléculas pequeñas como las partículas de colorante, tiene el potencial para prevenir la filtración bacteriana que tiene un tamaño molecular más grande. (43) Otros autores como Bates et al. (44) estudiaron la capacidad de sellado del MTA (Loma Linda University, Loma Linda, CA) como material de obturación del extremo apical, comparándolo con la amalgama con barniz cavitario y SuperEBA® en diferentes períodos de tiempo, 24 - 72 horas, 2 &endash; 4 &endash; 8 y 12 semanas, empleraon el método de filtración de fluidos. Utilizaron 66 dientes humanos extraídos monorradiculares, que fueron seccionados a nivel de la corona, instrumentados y preparados con la técnica telescópica, fueron obturados con gutapercha sin utilizar cemento sellador. Se realizó la resección apical en un ángulo de 90º con respecto al eje axial del diente, se realizó una cavidad apical con instrumentación ultrasónica de 3 mm de profundidad y se dividieron en tres grupos al azar. El MTA mostró un excelente sellado a las 12 semanas de inmersión en el fluido comparado con el SuperEBA®. La microfiltración del MTA y SuperEBA® fue menor que la de la amalgama a las 24 horas, 72 horas y 2 semanas. En los siguientes períodos de tiempo no hubo diferencias significativas entre los 3 materiales. Se ha reportado que el MTA presenta menor microfiltración que la amalgama, preparados de óxido de zinc-eugenol (2), (3), y el ionómero de vidrio convencional cuando es utilizado como material de obturación del extremo apical después de la resección apical. (45) Matt et al. (46), compararon la capacidad de sellado y dureza del ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK) y ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK), cuando son utilizados para crear una barrera apical en un solo paso o 2 pasos. Emplearon 44 dientes humanos extraídos monorradiculares, se colocaron barreras de MTA blanco y gris de espesores de 2 mm y 5 mm. Las muestras fueron obturadas inmediatamente (un paso) y después de 24 horas (2 pasos). Se sumergieron en azul de metileno durante 48 horas y luego fueron seccionadas las muestras, pudiendose observar que el MTA gris mostró menos filtración que el MTA blanco independientemente del espesor; al colocar el MTA utilizando la técnica de 2 pasos se observa menos filtración que en un solo paso y cuando se colocan barreras apicales de 5 mm aumenta significativamente la dureza que al colocar barreras de 2 mm de espesor, Gráfico Nº5 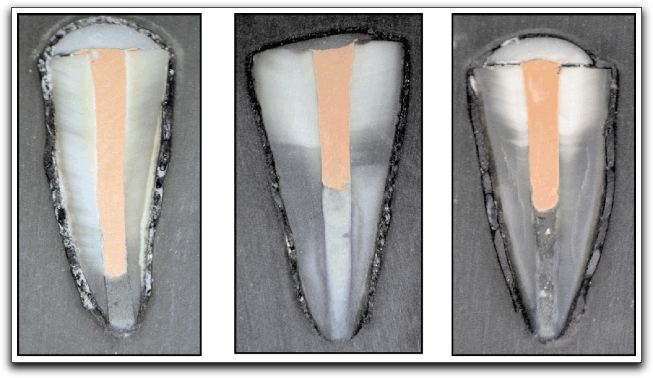
El espesor mínimo de MTA para lograr un sellado apical eficaz debe ser entre 3 mm y 4 mm para prevenir la microfiltración. (47) Gutierrez y Aranda (48) realizaron un estudio con el propósito de comparar la microfiltración apical del ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK), CPM® MEDIX, CPM® EGEO y Súper-EBA® en obturaciones del extremo apical utilizando un método de penetración de tinta. Utilizaron 42 dientes humanos extraídos monorradiculares, fueron instrumentados y obturados. A cada diente se le realizó la resección radicular y se prepararon las cavidades apicales con ultrasonido. Los dientes fueron divididos en 4 grupos de 10 dientes cada uno, los cuales fueron obturados con los 4 materiales en estudio. Se usó un control positivo y uno negativo. La microfiltración apical fue determinada usando tinta china. Los dientes fueron diafanizados y se midió la microfiltración de la tinción por medio de un microscopio estereoscópico a una magnificación de 20X. El análisis estadístico mostró que el SuperEBA®, CPM® EGEO (Egeo S.R.L., Buenos Aires, Argentina) y ProRoot® MTA gris presentaron menor microfiltración que el CPM® MEDIX representando éste último una diferencia estadísticamente significativa, lo cual puede ser debido a que a pesar de ser un material a base de MTA, es un cemento prototipo. Los autores mencionan que el SuperEBA®, CPM® EGEO (Egeo S.R.L., Buenos Aires, Argentina) y ProRoot® MTA gris son considerados como materiales adecuados para la obturación del extremo apical porque proporcionan un mejor sellado. Sin embargo, el uso del azul de metileno en estudios de sellado marginal ha sido cuestionado, debido a su incompatibilidad con sustancias alcalinas, ya que pueden inducir a la decoloración de la tinta. El CaO es uno de los componentes del MTA. Cuando el CaO se mezcla con el agua, resulta en la formación de hidróxido de calcio, con un posterior aumento en el pH. Por lo tanto, puede ocurrir la decoloración de las superficies manchadas por el azul de metileno. (49) Es por ello, que Broon et al. (50) analizaron la capacidad de sellado del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK), MTA Angelus® gris (Angelus Soluçöes Odontológicas, Londrina, Brazil) y PC no estructural (Irajazinho Votorantin Cimentos, Sao Paulo SP, Brasil) cuando son utilizados como materiales de obturación del extremo apical mediante la infiltración del colorante de rodamine B. Tomaron 40 dientes humanos extraídos premolares monorradiculares. Fueron instrumentados y obturados con gutapercha. Fueron seccionados 2 mm a partir del extremo apical, se prepararon y obturaron las cavidades apicales con los materiales en estudio e inmediatamente fueron inmersas en solución de rodamine B al 0,2% por 72 horas. El análisis de la filtración del colorante fue realizado por medio de un microscopio óptico y se utilizó la prueba estadística de Kruskal-Wallis. En todos los especímenes hubo filtración marginal con índices variables, donde el MTA Angelus® mostró menor índice de filtración (2.5) que el ProRoot® MTA (3.0) y el PC (3.0). Los resultados demostraron que no hubo diferencias estadísticamente significativas entre los tres materiales. El PC no estructural está compuesto por un porcentaje menor de CaSO4 (responsable por el prolongado tiempo de endurecimiento), en comparación con el CP estructural. Por ese motivo se suprimió de la fórmula del MTA Angelus®, lo que explica porqué, en éste estudio mostró menores índices de filtración, debido a que impidió la filtración del colorante, por la disminución de su tiempo de endurecimiento. La adicción del CaCl2 mejora la capacidad de sellado del MTA blanco y gris, probablemente porque este componente acelera la reacción de gelificación. (51) Por otra parte, Estrello et al. (52) evaluaron in Vitro la capacidad sellado apical del PC gris tipo I y del ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK), utilizados como materiales de obturación del extremo apical. Tomaron 20 dientes humanos extraídos, a los cuales se les realizaron los tratamientos de conductos. Se realizaron las preparaciones y obturaciones de las cavidades apicales. Las muestras se dividieron en 2 grupos de 10 cada uno, el grupo I correspondía a los dientes obturados con ProRoot® MTA y el grupo II al PC gris tipo I. Los especímenes permanecieron sumergidos por 24 horas en azul de metileno al 1% a temperatura ambiente, en una campana al vacío a una presión de 15 mmHg. Concluido este período, los especímenes fueron seccionados y analizados en el microscopio estereoscópico (10x), observando el grado de filtración por medio de la penetración en mm del azul de metileno. Los resultados demostraron que el grupo que presentó mayor grado de filtración fue el obturado con ProRoot® MTA. De igual manera se observó que de las 20 muestras, 10 presentaron filtración. Sin embrago, se observó que no existe diferencia estadísticamente significativa entre ambos grupos experimentales, comportándose de forma similar. Asimismo, Hamad et al. (53) en su estudio compararon el ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) blanco y gris en el sellado de perforaciones de furca por vía ortógrada y retrógrada, con el objetivo de medir los niveles de microfiltración de ambos materiales. Los resultados mostraron que no había diferencias de filtración entre las dos presentaciones de MTA, pero el hallazgo más importante fue la evidencia de filtración en dirección ortógrada, lo cual sugiere la necesidad de colocar un adecuado material de sellado coronario en las perforaciones de furca para evitar la microfiltración coronaria. También Pelliccioni et al. (54) compararon in Vitro diferentes momentos de la microfiltración del ProRoot® MTA gris y blanco (Dentsply Tulsa Dental, Tulsa, OK) mezclados con agua destilada según recomienda el fabricante y obturadas sólo con el polvo sin previa hidratación. Utilizaron 44 raíces de humanos extraídas monorradiculares, se les seccionó la corona, fueron instrumentadas y obturadas con gutapercha sin sellador, se seccionó los últimos 3 mm apicales, se realizó la retropreparación con ultrasonido. Se hicieron 2 grupos aleatorios, un grupo con 22 dientes se obturó la cavidad apical con MTA blanco, mezclado según las indicaciones del fabricante y el segundo grupo con 22 dientes fueron obturados con sólo el polvo del MTA blanco. Se evaluó la microfiltración a las 24 horas, 1, 2, 4 y 12 semanas. No se encontraron diferencias estadísticamente significativas entre ambos grupos, excepto a la 1 semana. La influencia de la variabilidad experimental fue evaluada en diferentes momentos, dicha influencia no fue siempre importante excepto a la 1 semana, lo que significa que las condiciones experimentales se mantuvieron lo suficientemente estables. Este hecho pudo deberse a la dificultad que presentó el material seco, sin hidratarse, en transformarse en un sólido, en presencia de una insuficiente cantidad de líquido. Está claro, que la falta de agua durante la preparación del cemento en este estudio in Vitro no afectó la capacidad de sellado del ProRoot® MTA. Mientras que Shahi et al. (55) realizaron un estudio in Vitro donde evaluaron la capacidad de sellado del ProRoot® MTA blanco y gris (Dentsply Tulsa Dental, Tulsa, OK) cuando es utilizado como material de obturación del extremo apical, mezcladondolos con agua destilada y CHX al 0,12%. Utilizaron 96 raíces de humanos extraídas monorradiculares. Fueron preparadas con la técnica paso atrás, obturándose con gutapercha y sellador. Posteriormente se removió 2 mm de la corona, hasta el material de obturación. Las cavidades de acceso fueron selladas con Cavit®. Se seccionaron y prepararon los últimos 3 mm apicales con instrumentación ultrasónica. Los dientes se dividieron en 4 grupos. Las cavidades fueron obturadas con los materiales experimentales. El grupo A fue obturado con ProRoot® MTA gris mezclado con agua destilada, según las instrucciones del fabricante, el grupo B estaba representado por el mismo material pero mezclado con CHX al 0,12%, el grupo C y D correspondía al ProRoot® MTA blanco mezclado con agua y CHX respectivamente. Se mantuvieron durante 72 horas en la tinta India y posteriormente fueron seccionadas y observadas bajo estereomicroscopio. Los resultados demostraron que no hubo diferencias significativas en la capacidad de sellado para ambas presentaciones de MTA cuando es mezclado con agua destilada o CHX al 0,12%. Se sugiere que la mezcla del MTA con CHX no compromete la capacidad de sellado del material. Por otro lado, Rivera et al. (56) determinaron la capacidad de sellado del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK), PC puzolana y fosfato de zinc, cuando son utilizados para el sellado cervical de dientes tratados endodónticamente, mediante la filtración de azul de metileno. Se seleccionaron 150 dientes humanos extraídos monorradiculares, dividiendose en 5 grupos. A los grupos 1, 2 y 3 se les realizaron los tratamientos de conductos y se dejó libre los 3 mm coronales para sellarlos con los materiales a evaluar, el cuarto grupo únicamente se obturó completo. Los dientes fueron sumergidos en azul de metileno durante 2 y 7 días. Se midió la filtración a través de la obturación hacia el conducto en milímetros con microscopio óptico. El grupo 5, sólo se le realizó la apertura de la cámara, para que sirviera como control positivo. Al utilizar MTA blanco y PC no se evidenció filtración en 12 de 15 conductos. Los resultados no mostraron diferencias significativas entre el MTA y el PC en ambos períodos. Los niveles de filtración fueron mayores para los grupos con fosfato de zinc y sin material de sellado cervical. Asimismo, Orosco et al. (13) realizaron un estudio con el propósito de evaluar la capacidad de sellado del MTA Angelus® gris (Angelus Soluçöes Odontológicas, Londrina, Brazil), CPMTM (Egeo S.R.L., Buenos Aires, Argentina) y MBPc (resina epóxica con hidróxido de calcio) cuando son utilizados en barreras apicales. Emplearon un modelo de filtración de tinta utilizando Rodamine B al 0,2%. Utilizaron 98 raíces de humanos extraídas monorradiculares, fueron instrumentadas y preparadas. Fueron divididas en 3 grupos experimentales, de 30 dientes cada uno. Se colocó 5 mm de barrera apical con el MTA Angelus® gris, el CPMTM y MBPc respectivamente; y 2 grupos controles de 4 dientes cada uno. El resto de los conductos radiculares fueron obturados con compactación lateral. Los dientes de cada grupo fueron fijados y sumergidos en la tinta durante 48 horas. El análisis estadístico se realizó con la prueba de Kruskal-Wallis. Los resultados demostraron que la capacidad de sellado de los diferentes materiales en orden descendientes fueron los siguientes: MBPc (1.99 ± 1.44mm), MTA Angelus® gris (3.39 ± 1.39 mm) y CPMTM (4.00 ± 1.00 mm), determinando que el MBPc fue significativamente mejor que los otros materiales utilizados en barreras apicales. Sin embargo, Bramante en el 2006 citado por Orosco et al. (13) señala que de acuerdo con el fabricante es un material similar o con mejores propiedades físicas, químicas y biológicas cuando es comparado con el MTA, en las mismas condiciones clínicas. Este material es también un agregado de trióxido de mineral, este estudio evaluó la capacidad de utilizarlo como barrera apical, así como también su capacidad de sellado marginal. Sin embargo, muy pocos estudios se han realizado sobre este material. Debido a las limitaciones inherentes de los estudios de filtración por tinción y a radioisótopos y a la ausencia de correlación entre la filtración bacteriana y a las moléculas de tinción y de isótopos, los estudios de filtración bacteriana han sido recomendados para medir el potencial de los materiales de obturación. (57) Torabinejad et al. (42) determinaron in Vitro el tiempo necesario para que el Staphylococcus epidermis penetre 3 mm de espesor de la amalgama, Super EBA®, IRM® y el MTA (Loma Linda University, Loma Linda CA) cuando estos son utilizados como materiales de obturación del extremo apical. Tomaron 56 dientes humanos extraídos monorradiculares, fueron instrumentados y preparados utilizando la técnica telescópica. Se les realizó la resección apical de los últimos 3 mm apicales, se prepararon las cavidades obturándose con los distintos materiales. A través de la cavidad de acceso se les colocó el caldo del cultivo. Los resultados mostraron que la mayoría de las muestras que fueron obturadas con amalgama, SuperEBA® e IRM® comenzaron a filtrar desde los 6 hasta los 57 días. En contraste (8 de 10 especímenes), la mayoría de las muestras que contenían MTA no mostraron filtración durante el período experimental que fue de 90 días. El análisis estadístico de los datos no mostró diferencias significativas entre la filtración de amalgama, SuperEBA® e IRM®. Sin embargo, el MTA filtró menos que los otros materiales de obturación. Otro estudio, cuyos resultados corroboran que el MTA presenta una menor microfiltración bacteriana fue el realizado por Fisher et al. (58) donde determinaron el tiempo que necesitaba la Serratia marcescens para penetrar 3 mm de espesor en el SuperEBA®, amalgama libre de zinc, IRM® y el MTA (Loma Linda University, Loma Linda CA), cuando son utilizados como materiales de obturación del extremo apical. Emplearon 56 dientes humanos extraídos monorradiculares, se instrumentaron con el sistema Profile y se obturaron con gutapercha termoplastificada. Se realizó la resección de los últimos 3 mm apicales. Los dientes fueron divididos en grupos de 10 cada uno y fueron obturados con los materiales en estudio. S. marcensens se inoculó en cada una de las raíces. Se valoraron los días necesarios para la penetración bacteriana. El experimento duró 120 días. Los resultados señalan que las muestras obturadas con amalgama libre de zinc filtraron a partir desde los 10 días, para el IRM® a los 28 días y Super EBA® a los 42 días. Con el MTA no se observó filtración hasta el día 49. Al final del estudio (120 días), 4 de las muestras de MTA no mostraron filtración bacteriana. Debido al predominio de microorganismos anaerobios en las infecciones de origen endodóntico, el uso de un modelo de filtración anaerobia es clínicamente relevante. Es por ello que Nakata et al. (59) se valieron de un modelo de filtración bacteriana anaerobia para comparar la capacidad del MTA (Loma Linda University, Loma Linda CA) y la amalgama para sellar perforaciones de furca en molares humanos extraídos. Utilizaron 39 dientes multirradiculares, a los cuales se les eliminó la superficie oclusal y 5 mm de la porción apical, posteriormente se realizaron las perforaciones a nivel del piso cameral. Los molares fueron divididos aleatoriamente en 2 grupos experimentales. Se inoculó a través del acceso coronario un caldo de cultivo con Fusobacterium nucleatum. Los resultados mostraron que en las 18 muestras obturadas con MTA no se observó filtración, mientras que en 8 de las 18 muestras obturadas con amalgama si se evidenció filtración bacteriana después de 45 días. En otro estudio, Ferris y Baumgartner (60) compararon el ProRoot® MTA blanco y gris (Dentsply Tulsa Dental, Tulsa, OK) para determinar la capacidad de sellado en perforaciones de furca en molares humanos extraídos utilizando un modelo de filtración bacteriana mediante el Fusobacterium nucleatum. Los resultados demostraron que no hubo diferencias significativas en ambas presentaciones en permitir el paso del microorganismo. Adicionalmente, Ruiz et al. (61) evaluaron la microfiltración bacteriana del Enterococcus faecalis, utilizando diferentes materiales de obturación del extremo apical como la amalgama, SuperEBA®, ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK) y PC. Utilizaron 63 dientes humanos extraídos monorradiculares, se instrumentaron con la técnica de fuerzas balanceadas, fueron irrigados con hipoclorito de sodio (NaOCl) al 5,25%, EDTA al 17% y CHX al 0,12%. Se hicieron 4 grupos experimentales de 15 dientes cada uno y 3 grupos control de 1 diente cada uno, a los cuales se les realizo la resección de los últimos 3 mm apicales y la preparación de la cavidad apical se realizó con puntas ultrasónicas de diamante. Cada preparación se realizó siguiendo el eje longitudinal de cada diente y con una profundidad de 3 mm en cada uno de los casos. Los grupos experimentales se obturaron con los materiales en estudio. Los dientes fueron inoculados en la suspensión con el Enterococcus faecalis, y la porción apical se puso en contacto con el medio de cultivo durante 15 días. El grado de microfiltración bacteriana se valoró de acuerdo a la cantidad de bacterias observadas. Los resultados demostraron que todos los materiales analizados en este estudio presentaron microfiltración al microorganismo evaluado. De los 60 dientes estudiados, 40 presentaron microfiltración al E.faecalis. Al analizar la microfiltración en los grupos experimentales no se observaron diferencias significativas entre los diferentes materiales, ya que todos mostraron algún grado de microfiltración. El grupo obturado con el SuperEBA® y el ProRoot® MTA presentaron ambos la menor microfiltración (46,66%), el grupo del PC mostró una microfiltración del 80% y el grupo de la amalgama fue el que presentó la mayor microfiltración bacteriana (93%). El PC que parece tener una composición similar al MTA, en este estudio fue el segundo material que demostró la mayor microfiltración bacteriana en contraste con el SuperEBA® y el ProRoot® MTA, que fueron los materiales que presentaron la menor microfiltración. Los autores de este estudio sugieren que la valoración del grado de microfiltración mayor a los 15 días sería necesaria para conocer mejor el comportamiento de los materiales de obturación del extremo apical. Debido a que la mayoría de los fracasos endodónticos se deben a la presencia de bacterias en el conducto radicular, es importante conocer el grado de microfiltración bacteriana de los materiales más utilizados en cirugía periapical con el fin de elegir el material más adecuado en la práctica y aumentar la tasa de éxito de los tratamientos. (61) En resumen, el MTA ha sido estudiado utilizando métodos de tinta, filtración de fluidos y métodos de filtración bacteriana. La mayoría de los estudios basados en los métodos de tinta y de filtración de fluidos, muestran que este material en general, permite menor microfiltración que los materiales tradicionales cuando es utilizado como material de obturación apical. Asimismo, cuando se utilizan métodos de filtración bacteriana, muestra ser un material de sellado eficaz en el tratamiento de las perforaciones, como material de sellado del extremo apical y en el tratamiento de ápices inmaduros. (33) Sin embargo, se deben evaluar también otros parámetros a la hora de elegir un material de sellado apical adecuado como es su biocompatibilidad, el grado de citotoxicidad y la inducción a la cicatrización y reparación de los tejidos perirradiculares. (61)
3.- PROPIEDADES BIOLÓGICAS DEL AGREGADO DE TRIÓXIDO MINERAL Y DEL CEMENTO DE PORTLAND 3.1. Actividad antimicrobiana El material ideal de obturación debe proporcionar un adecuado sellado apical, ser estable dimensionalmente, ser radiopaco, no reabsorbible, no tóxico y ser tolerado por los tejidos periapicales. Además debería ser bactericida o bacteriostático. (9) Algunos estudios han demostrado el potencial antimicrobiano del MTA (62), (63),(42); y del PC (22). Esa actividad se evidencia por el elevado pH alcalino y por la concentración de iones hidroxilo. No obstante la actividad antimicrobiana del MTA es inferior a la del hidróxido de calcio, probablemente en razón de la disminución de la difusión iónica de los productos hidratados con el transcurso del tiempo. Baumgartner y Falkler (62) en 1991 investigaron la flora bacteriana de los últimos 5 mm apicales de conductos radiculares infectados. Encontrando que el 68% de las bacterias asociadas con lesiones periapicales eran anaerobias estrictas. Hong et al. (63) compararon el efecto antimicrobiano de la amalgama, SuperEBA® y MTA (Loma Linda University, Loma Linda CA) sobre 5 bacterias anaerobias facultativas: Lactobacillus sp, Streptococcus faecalis (actualmente reclasificado como Eenterococcus faecalis), Streptococcus mitis, Streptococcus mutans y Streptococcus salivarius. Los resultados mostraron que el MTA tiene un menor efecto antibacteriano sobre el Streptococcus fecaelis y posee un mayor efecto sobre las 4 bacterias restantes. El SuperEBA® fresco no mostró efecto antibacteriano sobre el Lactobacillus sp, Streptococcus faecalis y Streptococcus mutans; pero tuvo un ligero efecto sobre el Streptococcus mitis y el Streptococcus salivarius. Mientras que la amalgama no mostró efecto antibacteriano sobre ninguno de los microorganismos estudiados. Torabinejad et al. (9) sobre la base del trabajo realizado por Baumgartner y Falkler (62) en 1991; llevaron a cabo un estudio donde tomaron las muestras de las especies bacterianas encontradas en ese estudio, y compararon el efecto antimicrobiano de la amalgama, del óxido de zinc-eugenol, del SuperEBA® y del MTA (Loma Linda University, Loma Linda CA). El objetivo del mismo era evaluar la capacidad de los materiales de obturación del extremo apical en prevenir el crecimiento bacteriano de 9 bacterias anaerobias facultativas: Streptococcus fecalis (reclasificado actualmente como Enterococcus faecalis), Streptococcus mitis, Streptococcus mutans, Streptococcus salivarius, Lactobacillus species, Staphylococcus aureus, Staphylococcus epidermis, Bacillus subtilis y Escherichia coli. Además, evaluaron 7 bacterias anaerobias estrictas: Prevotella buccae, Bacteroides fragilis, Prevotella intermedia, Prevotella melaninogénica, Fusobacterium necrophorum, Fusobacterium nucleatum y Peptostreptococcus anaerobius. Los resultados indicaron que ninguno de los materiales estudiados demostraron actividad antimicrobiana sobre los microorganismos anaerobios estrictos. Cuando fue evaluado el MTA, se observó que tuvo efecto antimicrobiano, en 5 de los 9 tipos de bacterias anaerobias facultativas evaluadas. (9) Este efecto antibacteriano es atribuible a su alto pH luego de gelificar, o a la liberación de sustancias en el medio de crecimiento bacteriano. (4) Por consiguiente, Estrela et al. (22) determinaron la acción antimicrobiana del ProRoot® MTA gris (Dentsply, Tulsa Dental, Tulsa, OK.) , PC (Cia. Portland Cement Itaú, Itaú de Minas, MG, Brazil), Hidróxido de calcio en pasta (CHP, P.A., Quimis, Mallinkrodt Inc., St. Louis, MO, USA + saline solution), Sealapex® (Sybron-Kerr, Romulus, MI, USA) y Dycal® (Dentsply, Petrópolis, RJ, Brazil). Emplearon 4 cepas bacterianas: Staphylococcus aureus, Enterococcus faecalis, Pseudomonas aeruginosa y Bacillus subtilis, Fueron inoculadas 30 placas de Petri con 20 ml del agar infusión cerebro corazón (BHI) en 0,1 ml de la suspensión experimental. Se realizaron 3 cavidades, cada una con 4 mm de profundidad y 4 mm de diámetro en cada placa, posteriormente fueron rellenados con los materiales a prueba. Las placas fueron pre-incubadas por 1 hora a temperatura ambiente y posteriormente fueron incubadas a 37ºC durante 48 horas. Los resultados demostraron que la actividad antimicrobiana del CPH fue superior al ProRoot® MTA, PC, Sealapex® y Dycal®, para todos los microorganismos estudiados. El CPH mostró zonas de inhibición que van desde 6 a 9.5 mm y los rangos de difusión van desde 10 a 18 mm. El MTA, PC, y Sealapex® mostraron las zonas de inhibición dentro de este rango, donde éste último produjo la mayor zona. El MTA y el PC mostraron zonas de inhibición contra el S. aureus, y P. aeruginosa entre 7 y 8 mm respectivamente, y la inhibición del B. subtilis y C. albicans fueron similares para estos materiales. El PC mostró la difusión de una zona de 16 mm y el MTA de 14 mm contra el E. faecalis respectivamente. El Dycal® no mostró ninguna zona de inhibición microbiana. No obstante, Flores et al citado por Quintana et al. (64) en un estudio preliminar del PC ordinario, determinaron el crecimiento bacteriano y el pH de este material. Ellos establecieron que este cemento no favorece el crecimiento bacteriano, lo que se explica por su alta alcalinidad (pH de 10), por lo que no provee las condiciones óptimas para la proliferación bacteriana. El Enterococcus faecalis desempeña un papel importante en la etiología de las lesiones perirradiculares persistentes. Está asociado al fracaso endodóntico entre un 24% y 77%. Dicho microorganismo, posee varios factores de virulencia que contribuyen a su capacidad para sobrevivir a los efectos de la terapia endodóntica convencional. Es por ello, que diversos investigadores se han abocado en estudiar el efecto antibacteriano del MTA sobre dicho microorganismo. (65) Por otra parte, otro estudio realizado por Stowe et al. (66) evaluaron las propiedades antimicrobianas del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK) encontrando que éste inhibía el crecimiento del Enterococcus faecalis y el Streptococcus sanguis, y al mezclar el MTA con CHX al 0,12% en lugar de agua estéril, aumentaba su acción antibacteriana. Asimismo, trabajos publicados por otros investigadores han mostrado que el MTA retarda o impide el crecimiento del Enterococcus faecalis, teniendo una mayor actividad antibacteriana que otros materiales. (67), (68) En virtud de la diversidad de resultados reportados en los diferentes estudios, Al-Hezaimi et al. (69) compararon el efecto antibacteriano del ProRoot® MTA blanco y gris (Dentsply Tulsa Dental, Tulsa, OK) a diferentes concentraciones sobre el Enterococcus faecalis y el Streptococcus sanguis. Ambos tipos de MTA fueron preparados en concentraciones de 50, 25, 12,5, 6,25, 3,12 y 1,56 mg/ml de la dilución en agua destilada. Cada muestra fue llevada a un tubo que contenía el agar Sabouraud. Se inocularon los microorganismos, los grupos fueron incubados a 37ºC y se evaluó la turbidez del medio a las 0, 1, 24, 48 y 72 horas respectivamente. Los resultados indicaron que existe una correlación directa entre la concentración del MTA, ya sea de color gris o blanco, y su efecto antibacteriano sobre la cepa de los microorganismos estudiados. Los controles negativos no mostraron crecimiento bacteriano en cualquier período de tiempo, mientras que los controles positivos si mostraron crecimiento bacteriano, existiendo diferencias significativas entre ambos controles. En el período de tiempo cero, las muestras tanto del MTA gris como el blanco mostraron crecimiento bacteriano independientemente de la concentración y de los microorganismos. En los grupos del E. faecalis, los tubos que contenían el MTA gris en concentraciones de 50, 25, y 12,5 mg/ml no mostraron crecimiento bacteriano en todos los períodos de tiempo. Los tubos que contenían MTA blanco, mostraron crecimiento bacteriano en todas las concentraciones y períodos de tiempo. Igualemente, no se observaron diferencias significativas entre el MTA blanco y gris en concentraciones más bajas. En los grupos del E. sanguis, los tubos que contenían el MTA gris en las concentraciones de 50, 25, 12,5, 6,25 y 3,12 mg/ml no mostraron crecimiento bacteriano en todos los períodos de tiempo. La concentración de 1,56 mg/ml de MTA gris mostró crecimiento bacteriano en todos los períodos de tiempo. Los tubos que contenían el MTA blanco en concentraciones de 50, 25 y 12,5 mg/ml no mostraron crecimiento bacteriano en todos los intervalos de tiempo. No se observaron diferencias significativas entre el MTA blanco y gris en cualquiera de las otras concentraciones. En virtud de las condiciones de este estudio, los autores afirman que la susceptibilidad del E. faecalis y el S. sanguis difiere con el MTA. El MTA gris requiere de concentraciones más bajas que el MTA blanco para ejercer el mismo efecto antibacteriano independientemente del microorganismo. Igualmente, Holt et al. (41) realizaron un estudio in Vitro para comparar el efecto antimicrobiano del ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) en sus 2 presentaciones blanco y gris, sobre el Enterococcus faecalis cuando es mezclado con agua estéril o CHX al 2%. La prueba fue realizada mediante la colocación del MTA recién mezclado en placas de agar inoculadas con el Enterococcus faecalis y se compararon las zonas de inhibición a las 24 horas. Posteriormente, los valores fueron registrados y comparados. Los resultados mostraron que las zonas de inhibición fueron significativamente mayores para las muestras mezcladas con CHX al 2%. El MTA gris presentó mayores zonas de inhibición bacteriana que el MTA blanco. Por otro lado, otros trabajos de investigación han evaluado la actividad antifúngica del MTA. (22), (70), (71), (72) En este sentido, Al-Nazan y Al-Judai (70) evaluaron in Vitro el efecto antifúngico del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK). La actividad antifúngica fue evaluada sobre la Candida albicans, recién preparada la mezcla del MTA y después de 24 horas. La C. albicans se mantuvo en placas de agar Sabouraud y fueron incubadas durante 1 semana a 37ºC. Posteriormente, se colocó el MTA en 24 tubos, a los cuales se les agregó 2 ml de la solución de Candida. Para el control positivo de mezcló 1 ml del agar con 1 ml de suspensión de Candida y para el control negativo se agregó 2 ml del agar a los tubos. Utilizaron 6 tubos para la prueba. Las placas fueron incubadas a 37ºC y fueron evaluadas después de 1 hora, 1 día y 3 días. Al final de cada período de incubación, se tomaron 0,1 ml de la muestra y se transfirieron a los tubos que contenían 5 ml del caldo. Luego fueron incubados a 37ºC y observadas durante 7 días consecutivos. El crecimiento de los hongos fue observado a diario por la presencia de la turbidez del medio. Se determinó la presencia de la turbidez y se evaluó la pureza y morfología de las colonias. Los resultados fueron analizados estadísticamente mediante la prueba de Kruskal-Wallis. El control negativo no mostró crecimiento de hongos durante todo el período de observación, mientras que el control positivo si demostró crecimiento de la Candida albicans. Cuando la mezcla esta recién preparada, se evaluó el crecimiento durante la primera hora de incubación, mostrando que no hubo crecimiento en el tiempo 0 y tercer día de observación, al mismo tiempo se observaron resultados similares cuando fueron evaluadas después de 24 horas. Los resultados de este estudio demostraron que el ProRoot® MTA blanco a una misma concentración, es eficaz contra la Candida albicans, durante períodos de hasta 3 días. Es por ello, que Al-Hezaimi et al. (71) en un estudio similar, evaluaron in Vitro el efecto de diferentes concentraciones del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK) sobre la Candida albicans. El ProRoot® MTA blanco fue preparado a diferentes concentraciones: 50, 25, 12,5, 6,25, 3,125, 1,56 y 0,78 mg/ml respectivamente, diluido en 10 ml del agar Sabouraud, las cuales fueron fundidas a 45ºC. Posteriormente fueron vertidas en placas de Petri estériles. Se prepararon 348 placas de agar en total, se prepararon y dividieron para el grupo experimental 11 placas, y 5 para el grupo control. Las placas de agar que no contenían MTA sirvieron para el control positivo, y las placas que no tenían la C. albicans representaron el control negativo. Todas las placas fueron incubadas a 37ºC por períodos de 1, 24, 48 y 72 horas respectivamente. En cada intervalo de tiempo se evaluó la presencia de colonias de la C. albicans. Los resultados demostraron una correlación directa entre la concentración del ProRoot® MTA blanco y su efecto inhibitorio sobre la C. albicans. Las placas que contenían MTA en concentración de 50 mg/ml no mostraron crecimiento de las colonias en cualquiera de los periodos de tiempo evaluados, mientras que las muestras con la concentración de 25 mg/ml no mostraron crecimiento en 1 y 24 horas, pero a las 48 y 72 horas se observó crecimiento del hongo. Todas las placas que contenían concentraciones más bajas, mostraron en todos los periodos de tiempo, crecimiento de la C. albicans. Los controles positivos mostraron crecimiento de colonias, mientras que los controles negativos no demostraron crecimiento. Los autores determinaron que el ProRoot® MTA blanco en concentración de 50 mg/ml es eficaz durante períodos de hasta 3 días, mientras que concentraciones más bajas no son tan eficaces. En base al estudio anterior, Al-Hezaimi et al. (72) compararon el efecto inhibitorio de varias concentraciones del ProRoot® MTA blanco y gris (Dentsply Tulsa Dental, Tulsa, OK) sobre la Cándida albicans en un estudio in Vitro. Ambas presentaciones del ProRoot® MTA fueron preparadas en concentraciones de 50, 25, 12,5, 6,25 y 3,125 mg/ml respectivamente, diluidas con agua destilada. Cada mezcla recién preparada fue llevada a un tubo que contenía el agar Sabouraud, 1230 tubos se prepararon y dividieron en grupos experimentales de 11 tubos cada uno y los grupos control. Los tubos sin el caldo, bien sea con en MTA blanco o gris sirvieron como control positivo, y los tubos sin las colonias sirvieron de control negativo. Todas las muestras fueron incubadas a 37ºC, evaluaron la turbidez a las 0, 1, 24, 48, 72 y 168 horas (7 días) respectivamente. En cada período de tiempo los tubos fueron examinados por los signos visibles de crecimiento de las colonias. La mayor dilución sin crecimiento fue considerada como la concentración mínima inhibitoria. Fue evaluada y registrada la presencia o ausencia de turbidez en cada grupo. Además, se les añadió a las muestras 0,1 ml del agar para confirmar el crecimiento de la Candida. En general, se observó una relación directa entre la concentración de MTA, ya sea de color gris o blanco, en su efecto inhibitorio contra la C. albicans. En el período de tiempo 0, ambas presentaciones de MTA mostraron crecimiento de Candida independientemente de la concentración. Las muestras que contenían el MTA gris en todas las concentraciones probadas, no mostraron crecimiento del cultivo en cualquiera de los otros períodos de tiempo evaluados. Las que contenían el MTA blanco en concentraciones de 50 y 25 mg/ml tampoco mostraron crecimiento en los otros períodos de tiempo. Pero, la misma presentación en concentraciones menores, mostraron crecimiento de la colonia en todos los intervalos de tiempo. Cuando el MTA gris y blanco fueron comparados, las concentraciones de 50 mg/ml y 25 mg/ml mostraron actividad antifúngica por períodos de hasta una semana. Sin embargo, el MTA gris en concentraciones más bajas, sigue siendo efectivo, mientras que concentraciones similares o inferiores del MTA blanco no muestra ser tan efectivo en la inhibición de la Cándida albicans, cuando es comparado con el MTA gris. (72) 3.2. Mutagenicidad Considerando que un material de obturación apical ideal, no sólo debe sellar herméticamente la cavidad, sino también ser biocompatible y no carcinogénico, Kettering y Torabinejad (73) realizaron un estudio para evaluar el potencial mutagénico del IRM®, SuperEBA® y MTA (Loma Linda University, Loma Linda CA) por medio de la prueba de AMES, la cual está diseñada para determinar en materiales líquidos y sólidos su potencial carcinogénico. El IRM® y el SuperEBA® se mezclaron de acuerdo con las instrucciones del fabricante y el MTA fue mezclado en proporción 1:1 para la prueba. Los resultados demostraron que los 3 materiales no son mutagénicos según lo observado en la prueba de AMES. 3.3. Toxicidad El examen de la toxicidad es utilizado para determinar la biocompatibilidad de los diferentes materiales. La biocompatibilidad del MTA se ha investigado de varias maneras, utilizando células de expresión y crecimiento, implantes subcutáneos e intraóseos y en contacto directo con los tejidos dentarios en estudios in Vivo. (11) En este sentido, Pitt Ford et al. (74) compararon la respuesta pulpar cuando el MTA (Loma Linda University, Loma Linda CA) y el hidróxido de calcio (Ca(OH)2) son utilizados como materiales de recubrimiento pulpar. Para el estudio usaron los cuales fueron anestesiados con anestesia general. Se hicieron exposiciones pulpares de 1 mm de diámetro mediante aislamiento absoluto en 12 incisivos inferiores. Se controló la hemorragia antes de colocar los materiales en estudio con algodón estéril. El Ca(OH)2 fue mezclado de acuerdo con las instrucciones del fabricante, se colocó en el sitio de la exposición y el resto de la cavidad fue obturada con amalgama. El polvo del MTA fue mezclado con solución salina estéril en una proporción 3:1 y se colocó en toda la cavidad de acceso. Posteriormente, a los 5 meses los animales fueron sacrificados y se les realizaron las exodoncias de los dientes. Los especímenes fueron procesados para el examen histológico, para determinar la formación de un puente de dentina, presencia de inflamación y bacterias en las paredes de la cavidad. Todos los recubrimientos pulpares realizados con el MTA mostraron formación de un puente de dentina, observándose sólo en uno presencia de inflamación. El puente formado adyacente al MTA era similar a la dentina original. Por el contrario, en sólo 2 dientes tratados con el Ca(OH)2 se pudo evidenciar la formación de un puente dentinario, observándose en todos la presencia de inflamación pulpar severa donde predominaron los leucocitos polimorfonucleares. No se observó la presencia de bacterias en la cavidad, al igual que con el MTA. Sus autores opinan que la respuesta pulpar insatisfactoria obtenida con el preparado de Ca(OH)2 y cubiertas con amalgama, podría ser debido al hecho que ésta última no proporciona un sellado hermético, no siendo por ende, el resultado de la falta de biocompatibilidad del Ca(OH)2. La presencia de células inflamatorias crónicas y de leucocitos polimorfonucleares son el resultado de la microfiltración existente entre la amalgama y la estructura dentaria. Basándose en estos resultados, los autores recomendaron el uso de MTA como protector pulpar directo en casos de tratamiento de pulpas vitales. Asimismo, Torabinejad et al. (75) realizaron un estudio en monos para evaluar la respuesta del tejido periapical cuando es utilizado el MTA gris (Loma Linda University, Loma Linda, CA) y la amalgama libre de zinc (Kerr) como materiales de sellado del extremo apical. Se eliminó la pulpa de todos los incisivos superiores de 3 monos. Los conductos fueron preparados y obturados con gutapercha. Las cavidades de acceso fueron restauradas con amalgama. Se realizaron colgajos mucoperiósticos, se hicieron las resecciones apicales y se prepararon las cavidades de 2 mm de profundidad con una fresa de carburo número 2 y se obturaron con los materiales en estudio. Después de 5 meses, la respuesta del tejido perirradicular fue evaluado histológicamente, determinando los siguientes parámetros: concentración, extensión de la inflamación y células inflamatorias predominantes en el tejido perirradicular adyacente a los materiales de obturación. Además, fue evaluada la presencia o ausencia de bacterias en los dientes, cápsula de tejido fibroso, deposición de cemento sobre la raíz y los materiales, y la formación de hueso nuevo. El examen histológico demostró que los tejidos perirradiculares de todas las raíces obturadas con amalgama (6 raíces) mostraron inflamación de moderada a severa, mientras que las obturadas con MTA (6 raíces), sólo una mostró inflamación severa. Las células inflamatorias predominantes en los dientes obturados con amalgama fueron los linfocitos, sin embargo también se observaron leucocitos polimorfonucleares y cápsula de tejido fibroso. Igualmente se observó para ambos materiales, formación de cemento sobre la superficie de la dentina de la raíz resecada y sobre el MTA como una capa continua y espesa, mientras que en la amalgama no se observaron éstas características. Tampoco se evidenció la presencia de bacterias. Hubo formación de hueso nuevo independientemente del material utilizado. En opinión de los autores, los resultados de este estudio soporta el uso del MTA como material de sellado del extremo apical en humanos. Pitt Ford et al. (74) y Torabinejad et al. (75) mostraron que el MTA tiene capacidad para estimular la liberación de las citocinas de los osteoblastos, lo que indica que promueve activamente la formación de tejido duro, hecho que demuestra que no se trata de un material inerte. La participación del MTA en la estimulación de la respuesta celular, según Koh et al. (76) se debe a la fase de fosfato de calcio. Esta fase parece causar un cambio en el comportamiento celular, estimulando la adherencia de los osteoblastos al MTA. De acuerdo con Kettering y Torabinejad en 1994 citados por Koh et al. (77) las citoquinas son sustancias solubles capaces de activar otras células y son liberadas por una variedad de células. Son glicoproteínas de bajo peso molecular secretadas como resultado de la estimulación celular y son extremadamente potentes. Interactúan con receptores celulares produciendo cambios en la síntesis de ARN celular y proteínas, y por lo tanto en el comportamiento celular. Muy pocos materiales de sellado del extremo apical han inducido la formación de tejido duro, particularmente la formación de cemento, por lo tanto, el objetivo del estudio realizado por Koh et al. (77) fue determinar por qué la cementogénesis parece ser inducida por el MTA, mediante la investigación de una célula capaz de producir una matriz que puede calcificarse. La línea celular seleccionada, células MG-63 derivadas del osteosarcoma humano se cultivaron en medio de Ham en una incubadora de tejidos hasta observarse la confluencia. Se evaluaron 2 cementos, el MTA (Loma Linda University, CA) e IRM®. Todos los procedimientos se realizaron bajo condiciones asépticas en una cabina con un flujo laminar de aire filtrado. El IRM® se mezcló de acuerdo a las instrucciones del fabricante. Se prepararon 12 muestras de 20-25 gr en placas de Petri, a las cuales se les añadieron los medios de cultivo y se dejaron por 72 horas para madurar el cemento. Pasado este tiempo se prepararon mezclas frescas de IRM® y MTA. Se prepararon mezclas frescas de células, se colocaron en placas de Petri y se les añadió el medio de cultivo y los materiales. Se utilizaron placas de Petri sin cemento como control. Después de 1, 3 y 7 días respectivamente, se sacaron de la incubadora 4 placas de cada grupo y fueron fijadas con glutaldehído y tetraóxido de osmio. Se evaluaron 48 placas. Los especímenes fueron examinados en un microscopio electrónico de barrido. Se evaluó la morfología de las células de acuerdo a una escala: (1) células planas, (2) células parcialmente redondeadas, (3) células redondeadas y (4) células muertas. Para determinar la producción de las citoquinas se utilizaron 6 especímenes de cada grupo a cada intervalo de tiempo, las células fueron sembradas en placas, y las que no contenían cemento sirvieron de grupo control. El medio se removió de 6 placas de cada grupo a 1, 6, 12, 24, 48, 72 y 144 horas. El ensayo utilizó una técnica cuantitativa la cual es una fase sólida de ELISA que mide específicamente citoquinas humanas seleccionadas. Se investigaron las siguientes citoquinas: IL-1?, IL-1?, IL-6 y factor estimulador de colonias de macrófagos. La valoración por medio del microscopio determinó que hubo marcadas diferencias en la morfología celular entre las células cultivadas en presencia de IRM® (maduro o fresco) y aquellas cultivadas en presencia de MTA o solas durante 1 y 3 días. Las células cultivadas con MTA se mostraron planas y adheridas al cemento. Las células control tuvieron un crecimiento confluente, las células en presencia de IRM® fueron redondeadas y escasas. La media de los niveles de IL-1, IL-1 e IL-6 se incrementó cuando las células crecieron en presencia de MTA a las 72 horas, con valores aumentados en todos los intervalos de tiempo. Las células que crecieron solas o con IRM® produjeron cantidades indetectables de estas citoquinas. La producción del factor estimulador de colonias de macrófagos ocurrió en todos los grupos independientemente de la presencia del material Los resultados demostraron que la respuesta tisular estuvo caracterizada por células marcadamente redondeadas y disminución del número de células, indicando que el IRM® fue tóxico. La toxicidad del IRM® maduro fue similar al IRM® fresco, el componente tóxico es el eugenol. En presencia de MTA al día 1 y 3 se observó morfología normal de las células y crecieron en íntimo contacto con el cemento. Esto demuestra la biocompatibilidad del MTA. La respuesta de la línea celular con respecto a la producción de citoquinas ha demostrado ser similar a la de los osteoblastos humanos. Las citoquinas involucradas en la formación ósea pueden dividirse en 2 grupos, el primero incluye las citoquinas que estimulan la proliferación de células óseas pero inhiben los osteoblastos maduros, el segundo grupo estimula la proliferación de los precursores y la actividad de los osteoblastos maduros. La estimulación de los precursores de los osteoblastos es dirigida en preparación para la siguiente fase de formación ósea. (77) También, Osorio et al. (78) estudiaron la citotoxicidad del MTA (Loma Linda University, Loma Linda CA) y la compararon con la amalgama, Ketac Silver®, SuperEBA® y All-Bond 2®. Evaluaron la toxicidad de los mismos en un cultivo de fibroblastos de ratón y fibroblastos gingivales humanos. Observaron que el MTA tiene menor grado de citotoxicidad en comparación con los otros materiales indicados para el sellado del extremo apical. Tanto el MTA como el PC, se proponen como dos materiales muy similares por sus principales componentes: fosfato, calcio y silicio. El análisis macroscópico, microscópico y de fracción de rayos X, muestra que ambos materiales son casi idénticos. Para comprobar su biocompatibilidad, Wucherpfennig y Green (79) realizaron un estudio, en el cual fueron cultivadas células semejantes a los osteoblastos (MG-63) en presencia tanto de MTA como de PC. Los cultivos de 4 y 6 semanas mostraron que ambos estimulan la formación de una matriz en forma similar. También realizaron estudios en ratas adultas, en donde colocaron PC o MTA como recubrimiento pulpar directo después de una exposición pulpar estéril, se obtuvieron los especímenes para el análisis histológico a 1, 2, 3 y 4 semanas, donde se confirmó que ambos materiales tienen un efecto similar sobre las células pulpares; la aposición de la dentina reparadora se observó en algunos casos, tanto al inicio como a las 2 semanas después de producidas las lesiones. (79) Igualmente, otros estudios como el realizado por Estrela et al. (22) han mostrado que el MTA y el PC presentan propiedades biológicas similares. En opinión de los autores, a pesar de la ligera diferencia en sus composiciones, ambos materiales no son citotóxicos y a consecuencia de ello, permiten la adhesión celular, promoviendo la formación de hueso. Zhu et al. (80) evaluaron la amalgama, resina, IRM® y MTA gris (Loma Linda University, CA) con la finalidad de valorar la capacidad de adhesión de osteoblastos humanos mediante microscopio electrónico de barrido. Los resultados demostraron que después de 1 día se observó la adhesión de osteoblastos sobre la superficie de la resina, formando una monocapa. Los osteoblastos también mostraron una buena adhesión y difusión en la superficie del MTA. Al contrario ocurrió con la amalgama e IRM®, donde no hubo una adecuada adhesión ni propagación de los osteoblastos y se observaron células redondeadas. De acuerdo con los autores, la interacción de los osteoblastos en contacto directo con los materiales de obturación del extremo apical, podrían desempeñar un papel importante en la cicatrización de las lesiones perirradiculares. Este estudio demostró que los osteoblastos tienen una respuesta favorable sobre la resina y el MTA, en comparación con el IRM® y la amalgama. De la misma manera, Keiser et al. (81) compararon la citotoxicidad del MTA gris (Loma linda University, Loma Linda, CA) SuperEBA® y la amalgama en su aplicación como materiales de sellado del extremo apical, utilizando como cultivo experimental los fibroblastos del ligamento periodontal humano. Para ello, se utilizó la prueba de variabilidad celular para medir la actividad mitocondrial de los fibroblastos del ligamento periodontal después de 24 horas de haber sido expuestos a diferentes concentraciones con los materiales en estudio. Se utilizó el metacrilato de metilo al 2% para el control positivo. Los materiales fueron mezclados de acuerdo con las indicaciones del fabricante. Se evaluaron los materiales recién mezclados y a las 24 horas, formando 2 grupos respectivamente. Las diferencias en los promedios de los valores de la variabilidad celular fueron evaluadas a través del método ANOVA. Los resultados demostraron que dentro del grupo constituido por los materiales recién mezclados, la amalgama presentó la mayor toxicidad, seguida por el SuperEBA® y el MTA, no encontrándose diferencias significativas entre los 2 primeros. El segundo grupo, donde los materiales fueron evaluados a las 24 horas, se observó que la amalgama demostró ser menos tóxica, con respecto al SuperEBA® no mostró diferencia importante y la toxicidad del MTA disminuyó significativamente después de este periodo de tiempo. En la presente investigación, el MTA demostró ser menos tóxico para las células humanas del ligamento periodontal, al igual que el SuperEBA®, a las 24 horas y recién mezclados. Por su parte, Holland et al. (82) analizaron la reacción del tejido conectivo subcutáneo de ratas implantando tubos de dentina rellenos con PC (cemento Itaú® de minas Gerais), MTA gris (Loma linda University, Loma Linda, CA) e hidróxido de calcio químicamente puro (Reagen, Quimibrás Indústrias Químicas S/A, Rio de Janeiro, RJ, Brazil), y observar si estos materiales producen estructuras calcificadas. Los tubos de dentina fueron preparados como conductos radiculares de humanos, se rellenaron con los materiales a prueba. Se implantaron en la zona dorsal a cada lado de la línea media en 30 ratas. Se implantaron tubos sin material en otros 10 especímenes para el grupo control. Los animales se sacrificaron después de los 7 y 30 días del postoperatorio. Los tubos y los tejidos circundantes fueron removidos y fijados en formalina y se seccionaron con un micrótomo. Algunas secciones fueron teñidas con la técnica de Von Kossa, y otras fueron analizadas bajo un microscopio de luz polarizada. Los resultados demostraron que el hidróxido de calcio químicamente puro entre los 7 y 30 días mostraron resultados similares. Se observaron numerosas granulaciones de calcita y extensas áreas de tejido irregular cerca del tubo. En el interior de la pared de los túbulos dentinarios se observó la formación de una capa a diferentes profundidades. Las secciones descalcificadas, mostraron basófilos irregulares e inclusiones celulares. En torno a esta zona, a los 7 días, hubo una reacción inflamatoria crónica de leve a moderada y la presencia de células gigantes. A los 30 días, se observó en el tejido conectivo con zonas fibrosas calcificadas con células gigantes y una reacción inflamatoria crónica leve. Los resultados observados con el MTA y el PC fueron similares a los observados con el hidróxido de calcio a los 7 y 30 días. Se observó un menor número de granulaciones de calcita que las observadas con el hidróxido de calcio y en contacto con el material de relleno. Igualmente se observó zonas irregulares junto a las granulaciones y en el interior de los túbulos formando una capa a diferentes profundidades, pero en general adyacente al material de relleno. En base a lo anterior, se cuestiona de cómo este mismo fenómeno es producido por el MTA y PC, ya que ambos no presentan en su composición hidróxido de calcio. (82) Torabinejad et al. (4) señalan que el MTA muestra fases específicas en todo el material después de la reacción con el agua. Hay que recordar que el MTA está constituido por CaO y fosfato de calcio. Aunque no presenta entre sus componente hidróxido de calcio, el CaO reacciona con los fluidos de los tejidos para formar hidróxido de calcio. No esta aún dilucidado si esto mismo ocurre con el PC, pero los resultados similares entre ambos materiales sugieren la posibilidad de que esto ocurra. Los resultados de este estudio confirman los resultados de otras investigaciones, donde sugieren que el MTA y PC son materiales similares. (22), (79) Los autores indican que el mecanismo de acción del MTA y PC con respecto a la deposición de tejido duro, es similar a la del hidróxido de calcio. Con el propósito de confirmar estos resultados, ese mismo año Holland et al. (83) compararon la respuesta pulpar en perros luego de realizar las pulpotomías y el recubrimiento pulpar directo con PC (cemento Itaú® de minas Gerais) y MTA gris (Loma linda University, Loma Linda, CA). Utilizaron 18 dientes de un perro joven, lo que correspondía a 26 raíces. El animal fue anestesiado de forma general, se realizaron las exposiciones pulpares bajo aislamiento absoluto, se controló la hemorragia y se colocaron los materiales en estudio los cuales fueron mezclados de acuerdo a las indicaciones del fabricante, dividiéndose en 2 grupos de 13 cada uno. Las cavidades de acceso fueron restauradas con óxido de zinc eugenol y amalgama. Posterior a los 60 días de tratamiento, el animal fue sacrificado y se realizaron las exodoncias correspondientes. Los dientes fueron fijados y seccionados, para luego descalcificarlos y teñirlos. Posteriormente, se realizaron los análisis histomorfológicos. Observaron que con el MTA hubo formación de puente dentinario en 10 casos y con el PC los resultados fueron similares, existiendo formación del puente de dentina en 11 casos, y ausencia de reacción inflamatoria para ambos materiales. Los resultados observados apoyan el estudio anterior, confirmando que el mecanismo de acción del MTA y PC es similar. (82) Tomando en cuenta que ambos materiales tienen formulaciones químicas similares, a excepción del Bi2O3 presente en el MTA (22), y que los resultados obtenidos fueron los mismos para ambos, se puede asumir que el Bi2O3 no influye sobre los resultados del tratamiento del tejido pulpar. (83) Por otro lado, Abdullah et al. (24) al estudiar el MTA gris (Loma linda University, Loma Linda, CA), el PC (Rugby cement (RC), Rugby, UK) y dos variaciones del PC con adición de CaCl2 al 10% y 15% respectivamente, para acelerar el endurecimiento; comprobaron altos niveles de liberación de citocina y de osteocalcina para ambos materiales. Con el MTA observaron que los índices de liberación de citocina y de osteocalcina se mantienen en progresión hasta 48 horas, y enseguida se produce una reducción de esos niveles. En cambio con el PC modificado con CaCl2 en las dos concentraciones, observaron que las cantidades de citocina y de osteocalcina todavía se mantenían elevadas hasta las 72 horas. También observaron un crecimiento celular significativo sobre la superficie de los materiales, cubriéndola totalmente, lo que demuestra su biocompatibilidad. En opinión de los autores, las células encontradas sobre la superficie del PC modificado con CaCl2 indican que la superficie del material no es irritante y no afecta la integridad estructural de la célula, manteniendo sus extensiones citoplasmáticas, evento importante que demuestra que esa configuración permite una integración dimensional con el tejido óseo. En vista de que aun no existían reportes sobre la diferencia biológica entre el MTA gris y blanco, cuando son implantados en tejido subcutáneo, Holland et al (84), estudiaron la reacción en tejido subcutáneo de ratas con implantes de tubos de dentina rellenos con MTA blanco (Loma linda University, Loma Linda, CA). La metodología utilizada fue muy similar a la empleada en un estudio citado anteriormente por Holland et al (82). Mediante el análisis de los resultados se observó granulaciones de calcita de estructura irregular, formación de un puente junto al material. Así mismo se observó, la presencia de las granulaciones en la pared de los túbulos. La deposición de los cristales de calcita observados en este estudio, parece ser muy importante para el mecanismo de acción del hidróxido de calcio que se forma después de mezclar el polvo del MTA con el agua. Los resultados de este estudio fueron similares a los reportados para el MTA gris realizado por Holland et al (82), lo que indica que el mecanismo de acción de ambas presentaciones es similar, descartando así diferencias entre ambos materiales. Sin embargo, estudios in Vitro como el realizado por Perez et al. (85), evaluaron la hipótesis de que células de osteosarcoma MG-63 y osteoblastos primarios reaccionan diferente al ProRoot® MTA gris y blanco (Dentsply Tulsa Dental, Tulsa, OK) por medio de: 1) La investigación de la adhesión de osteoblastos primarios y células de osteosarcoma MG-63 al MTA gris y a MTA blanco; y 2) la comparación del comportamiento osteogénico de ambas líneas celulares en contacto con éstos materiales endodónticos. Se prepararon 16 recipientes, de los cuales 8 contenían MTA gris y los otros 8 MTA blanco. Inmediatamente después de colocar las porciones de material en los recipientes, osteoblastos primarios y células de osteosarcoma MG-63 fueron agregados a los recipientes, en una concentración de 104 células por recipiente. Fueron colocados en una atmósfera de 5% de CO2 a 37°C. Después de 6, 9 y 13 días respectivamente, los recipientes se fijaron con paraformaldehído al 4%, se deshidrataron, y después de ser secados a punto crítico, las muestras se observaron a través del microscopio electrónico. Bajo las condiciones de éste estudio, se observó que las células MG-63 se adhirieron al MTA blanco por períodos de tiempo mayor que los osteoblastos primarios. No se observó diferencia entre ambas líneas celulares (osteoblastos primarios y células de osteosarcoma MG-63) en cuanto a la adhesión al ProRoot® MTA. La falta de adhesión de los osteoblastos primarios al MTA blanco en los períodos de tiempo mayores podría estar relacionada con diferencias en la rugosidad de la superficie o a la composición química de los materiales. La rugosidad y la topografía de una superficie es lo que dicta el tipo de contacto focal que puede ocurrir. Conforme las superficies son más rugosas, la proliferación celular disminuye y su actividad como osteoblastos secretorios maduros aumenta. Según los fabricantes, la diferencia en cuanto al tamaño de la partícula del ProRoot® MTA y del MTA blanco es mínima. Sin embargo, estos 2 materiales presentan una topografía de superficie muy diferente al ser estudiados en el microscopio electrónico. Además, en el MTA blanco hay una reducción importante en el componente de hierro al ser comparado con la formulación original del ProRoot® MTA, lo cual podría contribuir a que los osteoblastos no se mantengan adheridos a la superficie de éste material. Es posible que tanto los osteoblastos primarios como las células de osteosarcoma MG-63 tengan la capacidad de adherirse a ambos materiales. Sin embargo, conforme los osteoblastos se comienzan a diferenciar, pierden la capacidad de mantenerse adheridos al MTA blanco. Es opinión de los autores, que aunque no se puede tomar una relevancia clínica inmediata de estos estudios in Vitro, es importante para el clínico notar que las características de éstos 2 materiales difieren suficientemente para provocar diferentes respuestas celulares. La importancia de estas diferencias en un ambiente clínico debe ser establecida por estudios in Vivo a profundidad. (85) Por su parte, Saidon et al. (86) evaluaron la respuesta citotóxica del PC (Quikrete, Columbus, Ohio) y el ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK) y compararon la reacción tisular de ambos materiales en el hueso cuando son implantados en la mandíbula de conejillos de India. Comprobaron después de 2 meses y 12 meses, que la reparación ósea con un mínimo proceso inflamatorio, se producía adyacente a ambos materiales, lo que corrobora la tolerancia cuando son implantados, sugiriendo que ambos son igualmente compatibles. Con base en lo anterior, Quintana et al. (64) realizaron un estudio experimental, prospectivo y longitudinal con el objetivo de evaluar la biocompatibilidad del PC incluido en tubos de polietileno al ser implantados en tejido conectivo subepitelial de ratas. Utilizaron 10 ratas de la cepa Wistar, Se empleó un tubo de polipropileno, el cual fue cortado en segmentos de 4 mm de longitud, posteriormente dichos tubos fueron colocados en un recipiente con glutaraldehído al 2% durante 45 minutos, seguido de una irrigación abundante con suero fisiológico, manteniéndose así mientras fueron implantados. El PC fue preparado de la misma manera como es recomendado utilizar el MTA, es decir, tres partes de polvo y una de líquido (anestésico), mezclado con una espátula para cemento por 30 segundos hasta obtener una consistencia cremosa. Inmediatamente después, fueron llenados los tubos de plástico. Los tubos preparados se mantuvieron en un ambiente húmedo (gasas impregnadas de suero fisiológico) hasta su colocación en las ratas. A 9 ratas se les implantó un tubo incluyendo PC (área experimental) y un tubo vacío (área control), uno a cada lado de la línea media, dejando a la última rata como control. Los animales fueron sacrificados a los 8, 15, 30 y 45 días respectivamente después de la implantación. Cada sección conteniendo el tubo y el tejido adyacente se colocó en formol al 10%. Los bloques fueron deshidratados y embebidos en parafina, se hicieron cortes seriados de 6 ?m para su posterior tinción con hematoxilina y eosina. En este caso se perdieron 4 muestras, 2 del grupo de 8 días y 2 del grupo de 15 días (control y testigo). La décima rata sirvió como animal de control, es decir, en ésta se observó el tejido normal de la rata con la finalidad de tener un punto de comparación del tejido. Los hallazgos histológicos de ambas muestras a los 8 días demostraron la presencia de infiltrado inflamatorio, caracterizado principalmente por células polimorfonucleares, células linfoides y macrófagos. Igualmente se observó la expansión de la matriz celular en toda la zona de la implantación. A los 15 días en ambas muestras se observaron un infiltrado inflamatorio caracterizado por macrófagos y células linfoides, también se evidenciaron células cebadas, eosinófilos y abundante neoformación vascular. A los 30 y 45 días se continuaron observando macrófagos y células linfoides principalmente, así como también células gigantes multinucleadas de tipo Lanhans y neutrófilos. También se vio un incremento en la cantidad de células cebadas, la degranulación de éstas y el número de eosinófilos. La neoformación vascular fue más evidente sobre toda hacia la periferia de la lesión. Los resultados de los análisis histológicos muestran que no hubo diferencia entre el grupo control y el grupo experimental, en ambos se encontró una reacción inflamatoria de leve a moderada, observándose un infiltrado inflamatorio similar, donde a los 8 días era más notoria la presencia de polimorfonucleares y la expansión de la matriz celular debido al edema presente. A diferencia de 15, 30 y 45 días donde el infiltrado inflamatorio se caracterizaba por la presencia de macrófagos y células linfoides principalmente; cabe destacar la presencia de las células cebadas y eosinófilos que se incrementaron en número a este tiempo. Este hallazgo parece indicar una reacción de tipo alérgica a los tubos implantados. Los resultados del presente estudio inducen a varias reflexiones. En primer lugar se puede deducir que no existió diferencia en la reacción celular entre ambos grupos. Se detectó inflamación de leve a moderada tanto en los tubos implantados con cemento, como aquellos que no contenían el material. Por otro lado, esto pudo ser debido a que el tejido de los cortes examinados no estuvo en contacto directo con el PC. Sin embargo, algunos materiales pueden producir efectos en los tejidos circundantes, aún sin estar en contacto íntimo con ellos, lo que no es evidente con este material. Pareciera ser entonces que, si bien no se puede asegurar que el PC sea biocompatible al 100%, los autores señalan que no tiene efectos nocivos en los tejidos a distancia, cuando es implantado en tejido subcutáneo de las ratas. Por otro lado, Camilleri et al. (87) no encontraron diferencias significativas entre las dos presentaciones de ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK). Sin embargo ambos materiales si presentaron una reducción en el crecimiento celular cuando fueron fijadas durante 28 días. El material no presenta la misma propiedad de biocompatibilidad a través del tiempo que cuando está recién mezclado. Los autores refieren que esto podría indicar que la biocompatibilidad estaría relacionada con la cantidad de hidróxido de calcio producido durante la hidratación de la reacción. Por su parte, De Deus et al. (88) evaluaron la citotoxicidad del ProRoot® MTA gris (Dentsply; Tulsa Dental, Tulsa, OK, USA) MTA Angelus® gris (Curitiba, Paraná Brazil) y del PC (MAUA CP32-TYPO II; Lafarge, Rio de Janeiro, Brazil) sobre células endoteliales de humanos (ECV 304). Las 2 marcas de MTA fueron mezcladas de acuerdo con las instrucciones del fabricante. El PC fue esterilizado con óxido de etileno, y se mezcló hasta obtener una consistencia similar a la de los otros materiales en estudio. Las células endoteliales se obtuvieron del cordón umbilical. Fueron incubadas a 37ºC, en una atmósfera de 95%, 5% de dióxido de carbono, 100% de humedad durante 7 días, en un medio de crecimiento a base de suero bovino fetal y sulfato de gentamicina. Los efectos de los materiales sobre las funciones mitocondriales fueron medidos mediante una prueba calorimétrica. El intervalo de tiempo para cada experimento fue de 24- 48 y 72 horas respectivamente. La variabilidad celular se midió mediante la prueba de dimetiltriazoldipheniltetrazoilo (MTT). Todas las pruebas se repitieron 3 veces para asegurar la reproductibilidad. Los resultados fueron analizados estadísticamente. A las 24 horas, se observó una diferencia estadísticamente significativa entre los grupos experimentales y el grupo control (ausencia de material). En éste intervalo de tiempo, todos los cementos inhibieron la viabilidad celular. En todos los grupos experimentales, los cambios en la morfología de las células endoteliales humanas se observaron cerca de la muestra del material al final de las primeras 24 horas, pero no se encontraron diferencias significativas entre los materiales en estudio. A las 48 y 72 horas, los 3 materiales mostraron de forma similar, un pequeño efecto inhibitorio sobre la viabilidad celular; no encontrando diferencias estadísticamente significativas entre los materiales experimentales y el grupo control. Los autores señalan, que el efecto citotóxico observado al inicio de las 24 horas, pudo haber ocurrido por el elevado pH que presentan los materiales en estudio, siendo el causante de la desnaturalización de las células adyacentes y proteínas medianas. Éste efecto citotóxico inicial fue disminuyendo gradualmente a lo largo del experimento, permitiendo la reparación de los cultivos celulares. Los resultados positivos biológicos de esta investigación, resultan alentadoras para el uso del PC como un material restaurador en Endodoncia, pero se necesitan de más estudios antes de que sea justificado su uso clínico. Sin embargo, otro aspecto a considerar, es que se ha cuestionado el uso del PC en seres humanos, por contener sustancias contaminantes. En particular, existen inquietudes en relación con la presencia de arsénico en el PC, es por ello, que Duarte et al. (89) tuvieron como objetivo en su estudio, determinar la liberación de arsénico del PC gris (Votorantim Cimentos, Cubatao, Brazil), PC gris (Companhia de cimento Ribeirao Grande, Ribeirao Grande, Brazil), PC blanco (Cimento Rio Branco, Rio de Janeiro, Brazil), ProRoot® MTA gris (Tulsa Dental, Tulsa, Okla) y MTA Angelus® gris (Odonto-Lo´gika, Prod. Odont., Londrina, Parana´, Brazil). Las 2 marcas comerciales de MTA fueron mezcladas según las instrucciones del fabricante y las 3 marcas del PC fueron mezcladas hasta obtener una consistencia ideal. Una vez preparados, fueron colocados en tubos de plástico, los cuales fueron sumergidos en frascos de vidrio que contenían agua y un agente reactivo. El agua fue previamente ajustada hasta obtener un pH de 5.0, para garantizar la liberación del arsénico. Después de 3 y 168 horas, el agua en la que el material había sido sumergido fue analizada en relación con la presencia de arsénico mediante espectrofotometría. Los valores de liberación del contaminante del PC gris (Votorantim Cimentos, Cubatao, Brazil) fue de 0,007 ppm después de 3 horas y de 0,006 ppm después de 168 horas. Los demás materiales mostraron niveles de 0,002 ppm. Todos estos valores se encuentran muy por debajo de los niveles tóxicos. (89) La norma ISO 9917-1:2003 recomienda que los cementos a base de agua, deben contener menos de 2 mg/kg de ácido arsénico soluble. (90) El análisis estadístico mostró que no hay diferencias significativas en la liberación de arsénico entre los materiales después de las 3 y 168 horas. Los resultados demostraron muy bajos niveles de arsénico liberado por los materiales, lo que demuestra que no hubo contraindicación para el uso de estos materiales en la práctica clínica, en la medida de lo que al contenido de arsénico se refiere. Mandal y Susuki citados por Duarte et al. (89) señalan que el arsénico muestra un efecto cancerígeno. La teoría propone que las alteraciones en la reparación del ADN ocurren debido a que se fija fuertemente al grupo sulfidrilo, dando lugar a la inhibición de la reparación del ADN, originando mutaciones genéticas, y aumento de la proliferación celular. Sarkar et al. (21) en su estudio, tuvieron como propósito determinar en base a las propiedades físico-químicas la interacción entre el MTA y el medio bucal que conlleva a la respuesta biológica. La idea fundamental era determinar la naturaleza de esta interacción, específicamente para caracterizar la interacción del MTA con un tejido sintético fluido y paredes radiculares endodónticamente preparadas de dientes humanos extraídos. El entorno fue elegido para simular las condiciones in Vivo en el que se utiliza el MTA. El material fue expuesto al tejido sintético a 37ºC, se evidenciaron los componentes metálicos producto del precipitado, mostrando una estructura similar a la de la hidroxiapatita. Los dientes endodónticamente preparados y obturados con MTA y almacenados en el tejido sintético a 37ºC por 2 meses, mostraron en la pared de la dentina una capa adherente de hidroxiapatita, que se asemeja a su composición. Los autores concluyeron que el calcio es el ión liberado más dominante del MTA, reacciona con los fosfatos en el tejido sintético, dando origen a la hidroxiapatita. Igualmente, Vosoughhosseini et al. (91) compararon la biocompatibilidad del ProRoot® MTA blanco y gris (Dentsply; Tulsa Dental, Tulsa, OK, USA) en tejido conectivo subcutáneo de ratas durante 7-15-30-60 y 90 días, encontrando que ambos tipos de MTA provocaron una reacción inflamatoria severa después de 7 días, y posterior a los 15 días no hubo diferencias significativas. Mostraron que ambos producen una respuesta celular inflamatoria similar en cortos y largos períodos de tiempo.
4.- MECANISMO DE ACCIÓN DEL AGREGADO DE TRIÓXIDO MINERAL 4.1. Respuesta tisular Lee et al. (1) mencionaron que los principales componentes presentes en el MTA (Loma Linda University, Loma Linda CA) eran el 3CaO-SiO2, el 3CaO-Al2O3, el óxido tricálcico y el SiO2. Junto con los trióxidos hay otros óxidos minerales que son los responsables de las propiedades físicas y químicas de este material. Dos años más tarde, Torabinejad et al. (4) estudiaron las propiedades físicas y químicas del MTA. Ellos observaron que todo el MTA se dividía en 2 fases específicas, constituidas por el CaO y el fosfato de calcio. Comprobaron que el CaO se presentaba en forma de pequeños cristales y el fosfato de calcio como una estructura amorfa. Pitt Ford et al. (74) en su estudio observaron, la neoformación de tejido duro debajo del MTA (Loma Linda University, Loma Linda CA), cuando es utilizado como recubridor pulpar directo. En otros estudios se han observado, la formación de una capa de cemento sobre el MTA (Loma Linda University, Loma Linda CA), cuando es utilizado como material de obturación del extremo apical. (75), (92) Por ser el CaO uno de los componentes del MTA, estaría teóricamente explicada la acción similar de este material con la del hidróxido de calcio. (34) Con la finalidad de analizar mejor este punto, Holland et al. (93) implantaron en el tejido subcutáneo de ratones tubos de dentina rellenos con hidróxido de calcio y con MTA (Loma Linda University, Loma Linda CA). Los tubos se removieron a los 7 y a los 30 días, y se procesaron sin descalcificar. Se realizaron los cortes de tejido duro mediante un micrótomo, se analizaron con luz polarizada y la coloración de Von Kossa para sales de calcio. Los autores observaron, que con el hidróxido de calcio había en la luz del tubo formación de granulaciones de calcita y debajo de éstas se formó un puente de tejido duro. Con el MTA, observaron lo mismo, con la diferencia, que el número de granulaciones de calcita era un poco menor que el observado con el hidróxido de calcio y que esas granulaciones estaban en contacto con el MTA, lo que no sucedía con el otro material. Este estudio mostró la similitud de resultados entre el hidróxido de calcio y el MTA. Ambos materiales permiten la formación de granulaciones de calcita y un puente de tejido duro subyacente. Por lo tanto, el mecanismo de acción de ambos materiales sería el mismo. La reacción tisular del MTA (Loma Linda University, Loma Linda CA) es similar a la del cemento de obturación Sealapex. Este cemento contiene en su formulación el CaO. Al implantar el Sealapex en tejido subcutáneo de ratones, se han observado los mismos resultados descritos para el MTA, es decir, formación de granulaciones de calcita y puente de tejido duro. (94) Por otra parte, Cintra et al. (95) en su estudio, al evaluar y comparar la respuesta cuantitativa y cualitativa de la respuesta inflamatoria y el potencial de formación de hueso después de implantar en el hueso alveolar de ratas, tubos de polietileno rellenos con una resina epóxica que contenía hidróxido de calcio (MBPc) y ProRoot® MTA gris (Dentsply; Tulsa Dental, Tulsa, OK, USA), determinaron que en el grupo del MTA, la respuesta tisular fue similar a la señalada por Holland et al. (93) en su estudio. A los 30 días, algunos casos mostraron la presencia de un tejido mineralizado en estrecho contacto con el material y una pequeña línea de necrosis. En el grupo MBPc, se observaron algunas diferencias en la respuesta inflamatoria en relación con el MTA. La línea hialina era más amplia y gruesa que la necrosis observada con el MTA. Igualmente se evidenció el tejido en estrecho contacto con el material y presencia de basófilos, aunque menos organizados que con el MTA. A pesar de la zona necrótica y la presencia de basófilos más desorganizados en el grupo MBPc, la respuesta fue similar al grupo del MTA, lo cual puede poner un poco de analogía en relación al mecanismo de acción señalado por Holland et al. (93), cuando describió que el mecanismo de mineralización del MTA, era similar al observado con el hidróxido de calcio. En otro orden de ideas, la fase líquida saturada de iones de hidroxilo también parece ser la responsable de la presencia de una la ligera capa de necrosis superficial pulpar, situada entre el puente de tejido mineralizado y el material. También ha sido encontrado en pocos especímenes sometidos a pulpotomías con MTA o PC. Cabe destacar que la mayor parte de la veces, esa necrosis superficial está ausente, y cuando está presente, es mucho más delgada que la observada con el hidróxido de calcio químicamente puro. (84) 4.2. Reacción química Holland et al. (93) creen que el CaO del polvo del MTA, al realizarse la preparación de la pasta con agua, se convertiría en hidróxido de calcio. Éste, a su vez, en contacto con los fluidos tisulares, se disociaría en iones de calcio y de hidroxilo. Los iones de calcio, al reaccionar con el gas carbónico de los tejidos, darían origen a las granulaciones de calcita. Junto a esas granulaciones habría acumulación de fibronectina, que permitiría la adhesión y la diferenciación celular y por ende la formación de un puente de tejido duro. El pH de la pulpa y de los tejidos periapicales dependerá de su condición inflamatoria. En condiciones de normalidad, el pH es neutro o levemente alcalino (7,2 a 7,4). En inflamaciones agudas el pH desciende, volviéndose ácido (6,5 o menos) a causa del ácido láctico proveniente de la glicólisis anaeróbica de las células inflamatorias y en razón de la acumulación de dióxido de carbono en el lugar. Sin embargo en inflamaciones crónicas, el pH vuele a la neutralidad (7,0 a 7,2) por el aumento de la vascularidad tisular. (96) De esta forma, al utilizarse un material de pH alcalino como el hidróxido de calcio, el MTA o el PC, sobre la pulpa o en contacto con los tejidos periapicales, el pH tisular local se elevará debido a la solución saturada de iones de hidroxilo. (34) Para restablecer el equilibrio del pH del medio, el dióxido de carbono, el ácido carbónico o los iones de bicarbonato presentes en el medio, reaccionaran con los iones de hidroxilo, aumentando considerablemente las concentraciones de iones de carbonato. Estos a su vez, reaccionaran con los iones de calcio en solución formando en el tejido granulaciones de carbonato de calcio bajo la forma de calcita. (96)
5.- APLICACIONES CLÍNICAS DEL AGREGADO DE TRIÓXIDO MINERAL Principalmente, el MTA ha sido indicado como material para el sellado de perforaciones radiculares vía coronaria o quirúrgica (5) y para la obturación del extremo apical (3). Posteriormente, se comenzó a emplear como barrera apical para la inducción al cierre apical en dientes no vitales y cuyos ápices fueran inmaduros. Además, debido a sus propiedades se ha recomendado su empleo como recubridor pulpar directo y en pulpotomías vitales. (5) 5.1. Sellado de perforaciones radiculares La Asociación Americana de Endodoncistas en el Glosario de Términos Endodónticos define las perforaciones como una comunicación mecánica o patológica entre el sistema de conductos radiculares y la superficie externa del diente. (97) Dentro de los factores etiológicos se tiene la caries, procesos resortivos o factores iatrogénicos. Independientemente de la causa, la perforación permite la invasión bacteriana a las estructuras de soporte, dando lugar a procesos inflamatorios y pérdida del mismo, lo cual podría comprometer el pronóstico del diente. (97) Además, a largo plazo el pronóstico va a depender del tamaño, y localización de la perforación, duración de la exposición con un medio contaminado y la capacidad de sellado que tenga el material, el cual idealmente debería proporcionar un adecuado sellado, ser biocompatible, y tener la capacidad de inducir la osteogénesis y cementogénesis. (98) En este sentido, el MTA ha sido sugerido como material de sellado de las vías de comunicación entre el sistema de conductos radiculares y el periodonto, en razón de las propiedades que en diferentes circunstancias ha demostrado tener. (42), (92) 5.1.1. Vía intracoronaria Ante estas propiedades, Pitt Ford et al. (99) examinaron histológicamente la respuesta de los tejidos en perforaciones de furca experimentalmente inducidas, selladas con amalgama o MTA (Loma Linda University, Loma Linda, CA), tanto inmediatamente de producida, como después de ser contaminadas con saliva. Realizaron 30 perforaciones en furca en 7 premolares de perros. Los conductos fueron preparados y obturados con gutapercha. Las perforaciones se realizaron en el piso de la cámara, en la bifurcación. La mitad de los dientes fueron sellados inmediatamente con MTA y amalgama, después de controlar la hemorragia. En el resto de los dientes, las perforaciones se dejaron abiertas para la contaminación salival por 6 semanas para permitir la entrada de bacterias y la formación de lesiones inflamatorias en la furca. Los animales fueron sacrificados 4 meses después. Los bloques de tejido de la mandíbula fueron deshidratados y teñidos. Se determinó la presencia de inflamación, su máxima severidad y la extensión de la misma en el sitio de la perforación de todas las secciones examinadas. En los dientes sellados con MTA, la respuesta estaba caracterizada por una capa de inflamación y formación de cemento en 5 de 6 dientes, mientras que en los obturados con amalgama, siempre estuvieron asociados con inflamación de moderada a severa. En los especímenes donde la reparación estaba retardada, 3 de los 7 obturados con MTA estaban libres de inflamación, pero 4 estaban inflamados. En contraste, los sellados con amalgama estaba siempre presente la inflamación. La evidencia histológica demostró que el MTA tiene potencial como material para la reparación inmediata de perforaciones de furca. Cuando la reparación es retardada, hubo más especímenes asociados con inflamación. El MTA permite una respuesta considerablemente más favorable que la amalgama. En opinión de los autores, en casos de perforaciones de furca, recomiendan el completo sellado de la cavidad con MTA y la restauración definitiva del diente solamente 1 a 7 días después. La resistencia del MTA al desplazamiento a las 72 horas es mayor que a las 24 horas, eso indica que el material colocado en el lugar de la perforación debe mantenerse protegido por una restauración temporal, de endurecimiento rápido, dejándola 3 días sin tocarla. Por su parte, Arens y Torabinejad (100) reportaron 1 caso de sellado de una perforaciones en furca por vía intracoronaria mediante la utilización de MTA (Loma Linda University, Loma Linda, CA). Se trataba de un paciente masculino de 64 años de edad, el cual presentaba dolor e inflamación asociado con el primer molar inferior derecho. El paciente refirió que tenía un tratamiento de conductos desde hace 12 años y que hace 3 años le colocaron un perno intrarradicular, desde ese entonces, había experimentado episodios de dolor y edema. Fue aun Endodoncista, pero no logró retirar el perno, y fue referido a un cirujano para que le realizaran la exodoncia del diente. Sin embargo, el paciente decidió buscar una segunda opinión. Durante la evaluación clínica, se evidenció la presencia de un trayecto fistuloso, dolor a la percusión, edema y un saco periodontal de aproximadamente 12 mm. Radiográficamente se observó que el diente tenía un tratamiento de conductos y un perno en la raíz distal, el cual había perforado la furca hacia mesial de la raíz distal, observándose una zona radiolúcida entre el vértice de la cresta y las raíces. Gráfico Nº 6. 
Dentro de las opciones de tratamiento planteadas, estaban; extracción, amputación radicular, hemisección, sellado intraconducto con amalgama, IRM®, SuperEBA® y MTA, así como también regeneración tisular guiada, el paciente se decidió por realizar un abordaje intraconducto y sellar la perforación con MTA. El perno fue removido con instrumentación ultrasónica, sin embargo este procedimiento amplió la perforación a 4x5 mm y la amalgama que servía de restauración definitiva, parte de ella se alojó en el defecto perirradicular. Se realizó un curetaje cuidadoso. Se preparó el MTA hasta obtener una consistencia pastosa, se llevó con un portaamalgama al sitio de la perforación y se le colocó un algodón húmedo. Se tomó una radiografía inmediatamente, y se observó la extrusión del material en el defecto. Se colocó IRM® como material de restauración provisional. Gráfico Nº7. 
A los 3 meses de control postoperatorio, se evidenció actividad osteoblástica al observarse la regeneración ósea. A los 6 meses, el examen radiográfico demostró que la lesión estaba cicatrizando, y al año se observó casi por completo la reducción de la lesión radiográfica. Gráficos Nº8 y 9.
Los autores recomiendan precaución para que la colocación del MTA no se ejerza mucha presión, cubriéndolo posteriormente con una torunda de algodón húmeda y estéril, dejándola de 1 a 3 días para que continúe la gelificación del material. Igualmente, Schwartz et al. (101) discutieron las características físicas, químicas y clínicas del MTA (Loma Linda University, Loma Linda CA) y presentaron diversos casos clínicos para demostrar algunos de sus usos. Reportaron un caso de un paciente masculino de 27 años de edad, que fue referido para la evaluación endodóntica del primer molar inferior izquierdo. Gráfico Nº10. 
Durante la preparación de los conductos, el odontólogo hace referencia que había colocado Dycal® en los conductos mesiales y obturó el conducto distal con gutapercha. Al tratar de eliminar el Dycal® del conducto mesiolingual ocurrió la perforación. Al momento de la evaluación, el paciente refiere presión al morder y dolor espontáneo. Al examen clínico, se evidenció un saco de más de 3 mm de profundidad y molestia a la percusión. Los dientes adyacentes respondieron normal a las pruebas diagnósticas. Radiográficamente, se observó pérdida ósea en la zona de la bifurcación. Posterior a la evaluación, se procedió a realizar el tratamiento correspondiente. Bajo aislamiento absoluto, se eliminó todo el material contenido dentro de los conductos. Mediante el microscopio operatorio se visualizó la perforación. El conducto distal y el mesiovestibular fueron obturados de manera convencional con gutapercha y sellador. El conducto mesiolingual también fue obturado hasta el sitio de la perforación, y luego el MTA fue colocado en el tercio coronario del conducto. No se utilizó una matriz interna por lo cual hubo extrusión del material en la bifurcación. Durante la evaluación postoperatoria a los 6 meses, el diente estuvo asintomático, respondió normal a las pruebas diagnósticas, con sondaje dentro de los límites normales y sin evidencia radiográfica de que existiera alguna patología. Gráfico Nº 11. 
Los autores señalaron que el MTA es un material adecuado para el sellado de perforaciones. Adicionalmente, Holland et al. (102) desarrollaron un trabajo experimental en perforaciones laterales radiculares en dientes de perros. Las sellaron con Sealapex® y MTA (Loma Linda University, CA), y los resultados fueron analizados histológicamente, a los 30 y a los 180 días. Los mejores resultados se observaron con el MTA; en varios casos se produjo el sellado por formación de cemento nuevo y ausencia de inflamación en el ligamento periodontal. También se observaron pequeñas áreas de anquilosis, pero solamente durante 30 días. Con al Sealapex® se vió inflamación crónica en todos los especímenes y una pequeña formación de cemento nuevo sobre el material en sólo 3 casos. Por lo tanto, los resultados fueron mucho mejores con se utilizó el MTA. Entre todos los casos analizados en este estudio, los resultados más desfavorables fueron observados en los que tenían sobreobturación y el mayor número de sobreobturaciones se observó cuando se empleó el Sealapex®, teniendo como posible causa la facilidad de deslizamiento de dicho material. Por otra parte, en los últimos años, el uso de la magnificación ha ganado popularidad en la práctica clínica. El uso del microscopio operatorio, provee un mejor campo de visualización. Este hecho ha conllevado a un enfoque más conservador del sellado de las perforaciones, permitiendo el sellado de la misma por vía intrarradicular, y por ende, minimiza los daños físicos y psicológicos de la cirugía. Es por ello, que Daoudi y Saunders (103) evaluaron in Vitro el efecto del uso del microscopio operatorio en el sellado de perforaciones de furca utilizando ProRoot® MTA gris (Dentsply Maillefer, Ballaigues, Switzerland) y Vitrebond® (3M). Utilizaron 46 dientes humanos extraídos multirradiculares con raíces divergentes y furca intacta. Se montaron en una plantilla simulando una mandíbula. Las perforaciones se realizaron en el piso de la cámara pulpar con una fresa de carburo redonda (#2). La perforación correspondía al diámetro de la fresa y la profundidad dependía del espesor de dentina y cemento. Los dientes fueron divididos aleatoriamente en 4 grupos. El grupo 1 fue sellado con Vitrobond® y con el uso del microscopio operatorio, el grupo 2 se selló con MTA con la ayuda del microscopio y el grupo 3 y 4 fueron sellados con ambos materiales pero sin el uso del microscopio. Se utilizaron 6 dientes como control positivo y negativo, donde las perforaciones no fueron selladas. Los dientes fueron deshidratados y transparentados. El sellado de las perforaciones se evaluó bajo magnificación. El análisis estadístico demostró que las perforaciones selladas con MTA filtraron significativamente menos que con el otro material. Gráficos Nº12 y 13. 
Los resultados demostraron que el MTA mostró menos filtración en comparación con el Vitrebond®, aunque el microscopio operatorio ayudó en el procedimiento de sellado, no tuvo ningún efecto sobre el resultado de la reparación. Es importante tomar en cuenta, que la capacidad de sellado y la posible extrusión del material debe considerarse a la hora de elegir un material de sellado. Además, una adecuada visualización del sitio afectado, contribuirá a facilitar el procedimiento. La calidad de los sellados demuestra la dificultad del tratamiento de las perforaciones de furca. Son muchos los factores que pueden afectarla, como lo es la técnica utilizada, el material utilizado y las condiciones clínicas. (103) Por otro lado, Main et al. (104) reportaron una serie de casos con un tiempo de seguimiento, que muestra la respuesta de los tejidos perirradiculares cuando el MTA es utilizado en el sellado de perforaciones radiculares en humanos. Los pacientes fueron seleccionados de la Universidad de Loma Linda California, sólo los dientes tratados con MTA en el programa de Endodoncia. Los casos se escogieron sobre la base de los siguientes criterios: presencia de perforación radicular que estuviera sellada con MTA y constara con la documentación correspondiente, es decir, radiografías en el momento en que se le realizó el tratamiento y radiografías con un mínimo de seguimiento postoperatorio de 1 año. Sólo 16 pacientes cumplieron con estos criterios. Los resultados fueron registrados con presencia o ausencia de lesión perirradicular. La lesión fue definida como cualquier radiolucencia adyacente al sitio de la reparación superior al doble del ancho del espacio del ligamento periodontal normal. Todos los 16 casos también fueron evaluados clínicamente para determinar la presencia o ausencia de un defecto periodontal en el área de la perforación. De los 16 casos, 5 fueron clasificados como perforaciones laterales, 5 como perforaciones en banda, 3 como perforaciones en furca y 3 como perforaciones apicales. Gráficos Nº14, 15, 16 y 17. 
Ninguno de los dientes registró sacos periodontales mayores de 3 mm. 7 de estos pacientes presentaron lesiones radiolúcidas en el momento del sellado. El seguimiento de las radiografías osciló entre los 12 y 45 meses. Todos los casos con radiolucencias al momento del tratamiento, presentaron resolución durante la misma. Los otros 9 dientes no presentaban lesión radiolúcida en el momento del sellado y no se observó la aparición de imagenes durante el seguimiento. En general, la medida del tiempo transcurrido entre el postoperatorio inmediato y el seguimiento radiográfico fue de 25 meses. Este reporte de casos demostró la existencia de cicatrización con el uso del MTA como material de sellado de perforaciones radiculares, mostrando una notable mejoría en el pronóstico de los dientes sellados con este material. Sobre la base de los resultados de este estudio, el MTA es un excelente material para el sellado de perforaciones a diferentes niveles de la raíz. Sin embargo, Bargholz (105) presentó el concepto de matriz modificada para el sellado de perforaciones radiculares utilizando ProRoot® MTA gris (Dentsply Maillefer, Ballaigues, Switzerland). Las perforaciones laterales radiculares, son causadas accidentalmente durante y después de la preparación del espacio para el perno, con frecuencia muestran radiográficamente grandes defectos óseos. Gráficos Nº18 y 19.  
Para el éxito en el tratamiento de estos defectos, debe haber regeneración del espacio del ligamento periodontal. Lo cual va a depender, de la eliminación de bacterias del sistema de conductos radiculares y del sitio de la perforación, por lo que se debe hacer una adecuado desbridamiento químico-mecánico. En algunos casos, el tejido de granulación puede crecer en la perforación, éste, debe ser eliminado para permitir la reconstrucción exacta de la superficie radicular. Gráfico Nº20. 
Lemon en 1992 citado por Bargholz (105) presentó el concepto de matriz interna, para el tratamiento de las perforaciones, recomendaba el uso de la amalgama para el sellado de las mismas, indicando que había que realizarse la colocación del material con presión sobre una matriz externa de hidroxiapatita. Para la colocación del MTA, no es necesario aplicar presión, una vez mezclado el MTA tiene una consistencia suave y puede aplicarse sin presión. Trozos pequeños de colágeno (Kollagen-Resorb; Resorba,Nuremberg, Alemania) pueden ser utilizados para impulsar el tejido de granulación de la perforación y mantenerlo fuera de la raíz. Con la ayuda de un dispositivo especial o un portaamalgama se lleva el MTA sobre el colágeno para sellar la perforación (105), Gráficos Nº 21, 22, 23 y 24.  
La observación directa del sitio de la perforación a través del microscopio operatorio es muy útil para evitar bloquear el conducto y controlar la colocación del material. Una vez colocado el colágeno y sellada la perforación, la arquitectura radicular debe ser monitoriada radiográficamente. Gráficos Nº25 y 26.  
Estos mismos casos, en la evaluación postoperatoria al año, mostraron casi completa cicatrización de las radiolucencias, como consecuencia de la perforación, con formación de hueso nuevo. A los 5 años de evaluación, demostraron una excelente cicatrización con un espacio del ligamento periodontal continuo y visible en ambos casos. Gráficos Nº 27, 28, 29 y 30.  
29.
Este concepto de matriz interna modificada, promueve la cicatrización del ligamento periodontal, como se muestra en los casos. Sin embargo, son necesarios más estudios clínicos para investigar la previsibilidad de los resultados de la técnica. En opinión del autor, las perforaciones de larga data con inflamación periodontal pueden ser tratadas con éxito con MTA y el control de la infección en el conducto radicular y en el sitio de la perforación es necesario para el sellado satisfactorio de la perforación y para la cicatrización. Considerando, que el peor pronóstico de las perforaciones radiculares se debe probablemente al resultado de la microfiltración bacteriana y a la falta de biocompatibilidad de los materiales de sellado, Menezes et al. (106) en su artículo describieron un reporte de caso de una perforación iatrogénica supracrestal, en un segundo molar inferior izquierdo, la cual fue sellada con ProRoot® MTA gris (Dentsply, Tulsa Dental, Tulsa, OK, USA), demostrando un resultado satisfactorio desde el punto de vista clínico y radiográfico. A los 6 meses de evaluación, la cicatrización fue evidente en el sitio de la perforación, no había fístula, edema ni dolor. Después de 15 meses, el diente se mantuvo asintomático, radiográficamente mostró signos de normalidad. Gráficos Nº 31 y 32.  
Adicionalmente, el cambio de color del material ha ampliado las indicaciones del MTA, lo que permite su aplicación en perforaciones radiculares, pulpotomías, y como recubrimiento pulpar directo en dientes anteriores. A causa de ello, Bortoluzzi et al. (107) reporta un caso clínico donde demuestra la importancia de elegir MTA blanco para el sellado de perforaciones radiculares donde la estética está comprometida. Se trata de una paciente femenina de 19 años de edad, presenta una coloración oscura en el margen gingival vestibular adyacente al incisivo central superior derecho. La paciente refiere haber sufrido un traumatismo en dicho diente a los 8 años de edad, le realizaron una restauración clase IV y no ameritó la realización del tratamiento de conductos. A los 15 años presentó dolor en la zona, por lo que le realizaron el tratamiento de conducto en ambos incisivos centrales. A los 19 años, notó una coloración oscura en la superficie cervical del diente. Por motivos estéticos, el plan de tratamiento planteado en aquel momento fue la colocación de un perno intrarradicular en ambos dientes. Durante la realización de este procedimiento, se produjeron perforaciones radiculares en la superficie vestibular de ambos, debido a la inclinación excesiva de la fresa durante la preparación. Las perforaciones fueron inmediatamente selladas con MTA Angelus® en su presentación gris (Angelus Soluçöes Odontológicas, Londrina, Brazil). Después de 6 meses, la paciente observó la coloración oscura en la corona y en el margen gingival del incisivo central superior derecho. A la evaluación clínica, sólo se observó la coloración. Radiográficamente, todas las estructuras se observaron normales. Gráfico Nº 33. 
El nuevo plan de tratamiento consistió en reemplazar el MTA gris por el MTA blanco. Con aislamiento absoluto, se eliminó el MTA gris con fresas de diamante tallo largo bajo microscopio operatorio, evidenciándose la perforación en la mitad del tercio medio de la raíz. Gráfico Nº 34. 
El MTA blanco se preparó de acuerdo con las instrucciones del fabricante, se llevo a la zona de la perforación y también se colocó en la cámara de acceso para mejorar la estética. Se dejó una torunda de algodón húmeda y se colocó ionómero de vidrio como material de restauración provisional e inmediatamente la fotografía tomada mostró la ausencia de la coloración. Durante la evaluación al mes y a los 6 meses, el diente estaba totalmente asintomático, en ausencia de signos clínicos y radiográficos. Gráfico Nº35 y 36. 
Por otro lado, Hashem y Hassanien (108) evaluaron la capacidad de sellado del ProRoot® MTA gris (Maillfer, Dentsply, Switzerland), MTA Angelus® gris (Angelus Soluçöes Odontológicas, Londrina, Brazil) y el IRM® cuando son utilizados en perforaciones de gran tamaño, con y sin el uso de una matriz de colágeno. Utilizaron 80 dientes humanos extraídos multirradiculares. Fueron seccionados 3 mm por debajo de la furca, las perforaciones se realizaron con una fresa número 4. Se dividieron en 3 grupos, de 20 dientes cada uno: el grupo 1 se sellaron con el ProRoot® MTA, el grupo 2 fueron sellados con el MTA Angelus® y el grupo 3 con IRM®. El grupo 4 con 10 molares, representó el control positivo, donde las perforaciones no fueron selladas, y el grupo 5 fue el control negativo, con 10 molares a los cuales no se les realizó las perforaciones. Estos grupos se subdividieron en 2 subgrupos, de 10 dientes cada uno: el subgrupo A, no se les colocó la matriz interna, y el subgrupo B, se les colocó la matriz de colágeno. Se les colocó azul de metileno en las cámaras de acceso durante 24 horas. Los resultados arrojaron que el control positivo mostró mayor capacidad de absorción de la tinta. El grupo del IRM® sin matriz ocupó el segundo lugar. El grupo del MTA Angelus® sin matriz y el grupo del IRM® con matriz no mostraron diferencias significativas. El grupo del MTA Angelus® con matriz y el ProRoot® MTA con y sin matriz no mostraron diferencias significativas. Sin embargo, fue significativamente más alto que el control negativo. El IRM® sin matriz mostró una mayor filtración que los otros grupos. En base a los resultados obtenidos en este estudio, los autores afirman que el ProRoot® MTA tiene una excelente capacidad de sellado y se puede utilizar en el tratamiento de perforaciones de gran tamaño, el MTA Angelus® debe utilizarse con matriz de colágeno en este tipo de perforaciones para mejorar la adaptación y el uso del IRM® debe ser limitado para esta condición. Adicionalmente, el sellado de perforaciones como consecuencia de una resorción interna puede lograrse por vía intracoronaria o por vía quirúrgica, constituyendo así el MTA el material utilizado para dicho fin. (5) Por ello, Meire y De Moor (109) en su artículo describieron el tratamiento de una resorción interna perforante en la raíz mesial de un segundo molar inferior izquierdo, mediante el uso del ProRoot® MTA blanco (Dentsply Maillefer, Ballaigues, Switzerland). El caso clínico se trataba de un paciente masculino de 32 años de edad, que acude a consulta por presentar como hallazgo radiográfico una lesión resortiva en la raíz mesial de un segundo molar inferior izquierdo. Al examen clínico, mostró ligera molestia a la percusión, y respondió negativo a la prueba del frío. Los dientes adyacentes respondieron de forma normal a las pruebas. La evaluación radiográfica mostró un área radiolúcida ovalada, circunscrita, en el tercio cervical de la raíz mesial, y al lado de ésta se observó una imagen radiolúcida en forma de media luna en el hueso alveolar. Gráfico Nº 37. 
Mediante aislamiento absoluto se procedió a realizar el tratamiento. Una vez realizada la apertura, con la ayuda del microscopio operatorio se visualizó la cámara, observándose la necrosis superficial y el tejido vital por debajo. Se prepararon los conductos con ProTaper, se irrigó con hipoclorito de sodio al 2,5% y se observó la gran cavidad resortiva en el tercio coronario de la raíz mesiolingual. Gráficos Nº 38 y 39. 
La determinación de la longitud de trabajo se realizó con un localizador apical, se colocó hidróxido de calcio (Ultracal XS, Ultradent) en todos los conductos, porque el tejido de granulación no se pudo eliminar por completo mediante la instrumentación mecánica. Se realizó un recambio de la medicación a las 2 semanas. Posteriormente, a las 3 semanas, la cavidad resortiva estaba libre de tejido pulpar. La comunicación con la superficie radicular externa era evidente. Mientras que el conducto mesiolingual fue sellado con puntas de papel, el MTA blanco fue compactado dentro de la resorción utilizando un compactador. Gráfico Nº 40. 
Una vez más, se colocó hidróxido de calcio y ionómero de vidrio como material de restauración provisional. En la siguiente cita, se comprobó el endurecimiento del MTA. Los 3 conductos fueron obturados con gutapercha y sellador endodóntico AH26, utilizando una técnica de obturación combinada (compactación lateral en frío en la zona apical y compactación termomecánica utilizando guta conders). La cavidad de acceso fue restaurada con vidrio ionomérico provisionalmente. Gráfico Nº 41. 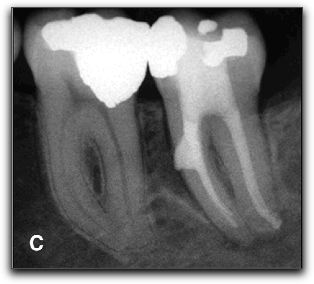
Gráfico Nº 41. C; Rx final inmediata. Tomado de Maire y De Moor, 2008. 109 La evaluación clínica y radiográfica a los 11 meses, mostró que el diente estaba asintomático, observándose una cicatrización satisfactoria de la radiolucencia mesial. Gráfico Nº 42. 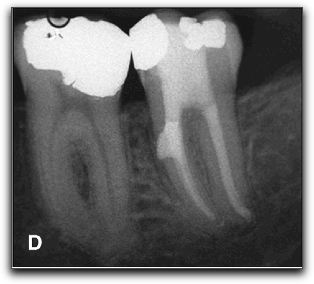
A los 2 años de evaluación, el diente estaba asintomático, y radiográficamente se observó la resolución completa de la radiolucencia mesial. Gráfico Nº 43. 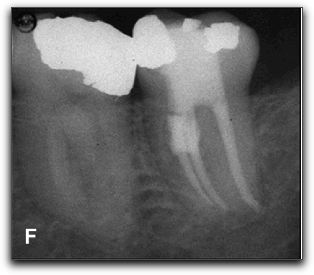
Los resultados demostraron que la respuesta biológica del MTA es excelente, observándose la completa cicatrización de la lesión durante la evaluación postoperatoria. En este tipo de perforaciones ocasionadas por resorciones internas, Torabinejad y Chivian (5) señalan que la preparación endodóntica es fundamental para remover el tejido de granulación en el lugar de la comunicación, completando con irrigaciones con hipoclorito de sodio y colocación del hidróxido de calcio. Posteriormente se debe proceder a la obturación del conducto con gutapercha y sellador hasta el lugar de la perforación. En el punto de la perforación se coloca el MTA con la ayuda de compactadores y conos de papel, después se coloca el algodón húmedo, el cual se debe dejar por lo menos durante 3 a 4 horas y se realiza la obturación provisional de la cavidad. Después de ese período, se elimina el algodón, y se procede a la restauración definitiva del diente. En casos de perforaciones intrarradiculares accidentales, recomiendan que la colocación del MTA debe realizarse por el conducto radicular con un portaamalgama y posteriormente condensado y puesto en capas con un compactador o una torunda de algodón, dejándolo de 3 a 4 horas. Después de ese período o en una segunda cita, se puede realizar la obturación definitiva. (5) Cuando el MTA es colocado en perforaciones con un alto grado de inflamación, el material puede permanecer blando cuando se evalúa en la segunda cita. Esto se debe a la existencia de un pH bajo que impide la gelificación apropiada. En estos casos, se debe retirar el MTA y repetir el procedimiento. (5) En perforaciones apicales, el material debe colocarse en la porción apical con un portaamalgama pequeño y empacarse con compactadores o puntas de papel. Se necesita de una barrera de 3 a 5 mm para prevenir la filtración coronaria y la extrusión del material de obturación hacia los tejidos periapicales. (5) 5.1.2. Vía quirúrgica El sellado de las perforaciones se logra intracoronalmente o quirúrgicamente. El acceso no quirúrgico o intracoronario usualmente precede al procedimiento quirúrgico. El factor importante en ambos abordajes es logran un buen sellado entre el diente y el material de sellado. (1) Cuando la reparación de las perforaciones fracasa después del abordaje intraconducto o si la perforación es inaccesible a través de la cavidad de acceso está indicado el abordaje quirúrgico. (5) En este sentido, Schwartz et al. (101) dentro de los casos reportados en su estudio para demostar las diferentes aplicaciones del MTA, documentaron un caso clínico de un paciente masculino de 72 años de edad, el cual tenía una corona provisional en el primer molar inferior derecho. Tenía dolor espontáneo e intermitente y molestia a la masticación. Durante el tratamiento se produjo una perforación en la raíz mesiovestibular 1 mes antes. Para ese momento había un defecto de furca en vestibular del diente de 4 mm de profundidad. Radiográficamente no se observaba la pérdida ósea. El odontólogo había decidido terminar el tratamiento de conductos, y evaluar al mes. Para ese momento la condición clínica había empeorado. En el examen radiográfico se observó una radiolucencia significativa a nivel de la furca y se registró un sondaje de 8 mm. Gráfico Nº 44. 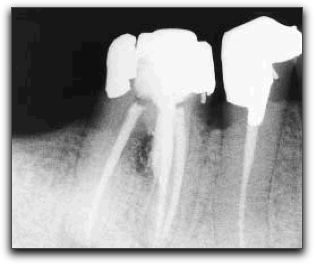
Se eliminó la gutapercha del conducto mesiovestibular hasta el punto apical de la perforación. Al visualizar la perforación se colocó MTA en la porción coronaria para sellarla. Durante el procedimiento, se compactó una combinación de gutapercha, sellador y MTA hacia la furca, por lo que se levantó un colgajo por vestibular y se eliminó el exceso de material. Con la ayuda del microscopio operatorio se visualizó la perforación en la superficie distolingual de la raíz mesiovestibular, y se colocó el MTA para mejorar el defecto creado. Gráfico Nº 45. 
Gráfico Nº 45. MTA colocado en la perforación. Tomado de Schwartz et al. 1999. 101 Se realizó un control postoperatorio a los 6 meses, el paciente estaba asintomático. Radiográficamente se observó la formación de hueso nuevo en la zona de la furca. Se registró un sondaje de 4 mm. Gráfico Nº 46. 
Por su parte, Hsein et al. (110) reportaron un caso donde mostraron la reparación quirúrgica de una perforación a consecuencia de una resorción interna sellada con ProRoot® MTA gris (Dentsply/Tulsa Dental, Tulsa, OK). Se trataba de una paciente femenina de 29 años de edad, la cual manifestó que desde hace varias semanas tenía inflamación en la zona anterosuperior. Durante una evaluación clínica pasada, le informaron que el origen de la inflamación correspondía al incisivo central. En aquel momento el diente fue abordado y preparado. Sin embargo, los signos y síntomas no cesaron. Al realizarle una nueva evaluación clínica, se observó edema, fístula a nivel del incisivo central superior izquierdo, caries extensa por distopalatino, donde tenía una restauración de resina, leve movilidad, dolor a la percusión y palpación y sondaje dentro de los límites normales. Al examen radiográfico se observó una imagen radiolúcida de forma ovalada, la cual fue diagnosticada como una resorción interna en el medio del conducto. Gráfico Nº 47. 
Se restableció el acceso al sistema de conductos, pero el conducto presentaba un continuo exudado y hemorragia como consecuencia de la resorción y por lo tanto no se lograba tener un conducto seco, por lo que se levantó un colgajo y se observó la perforación de la ventana ósea. La zona fue limpiada y secada y el conducto radicular fue instrumentado y obturado. El material de obturación se eliminó hasta la porción apical de la resorción. Se modificó un poco el defecto para poder realizar un curetaje adecuado. La perforación fue completamente cureteada e irrigada y se compactó el MTA dentro del defecto. Se reposicionó el colgajo y se suturó. Se colocó una torunda de algodón húmeda en contacto con el MTA antes de que fuera temporalmente sellado. El paciente regresó a la semana, encontrándose asintomático. Se retiraron los puntos de sutura y el material de obturación temporal. El espacio residual del conducto, desde el MTA hasta coronario fue obturado con gutapercha termoplastificada. El diente se restauró con resina. Se realizaron controles clínicos y radiográficos a los 12 meses, observándose resultados satisfactorios. Gráfico Nº 49. 
En este caso, el MTA dio lugar a una rápida solución de los síntomas y la intervención quirúrgica de la perforación y el sellado con este material podría ser una alternativa en el tratamiento de estos casos. El procedimiento clínico recomendado para el sellado de perforaciones vía quirúrgica es el siguiente: después de levantar un colgajo y localizar el sitio de la perforación, el defecto debe ser modificado con una fresa pequeña. Como el MTA no gelifica, sino después de 3 a 4 horas, es fundamental controlar por completo la hemorragia antes de hacer cualquier intento de reparar el área perforada. La presencia de excesiva de humedad en el campo operatorio hace que el material sea muy suave y difícil de controlar. Después de mezclar el polvo del MTA con agua estéril, se coloca en la cavidad preparada y se compacta con un compactador, luego remover el exceso con una cucharilla o con una gasa húmeda. No lavar el área después de colocar el MTA en el sitio de perforación. Se sutura el colgajo en su lugar y se evalúa la cicatrización. (5) 5.2. Material de obturación del extremo apical La cirugía endodóntica está indicada cuando existe una gran posibilidad de fracasar con un tratamiento endodóntico no quirúrgico, si existe un fracaso como resultado de un tratamiento o repetición de tratamiento de conductos y es imposible obtener un mejor resultado con la terapia convencional o cuando se requiere tomar una biopsia en o cerca del ápice radicular. (xx) Por consiguiente, se ha recomendado la colocación de materiales en el extremo apical en dientes que requieran una resección apical. (43) La resección y obturación del extremo apical por vía quirúrgica tienen como objetivo, lograr un sellado impermeable que evite la salida de cualquier agente irritante, desde el sistema de conductos radiculares hacia los tejidos perirradiculares. (43) Numerosos materiales han sido utilizados como materiales de obturación del extremo apical como lo es la amalgama, gutapercha, resina compuesta, ionómeros de vidrio, cementos de óxido de zinc, cementos de ácido ethoxybenzoico (EBA), entre otros. (81) Hasta ahora ninguno de estos materiales ha demostrado predeciblemente ocasionar la regeneración del periodonto a todo lo largo de la superficie radicular. (81) Recientemente el MTA se ha sugerido como un potencial material para el sellado del extremo apical. (4), (6), (43), (57), (75), (77), (81), (111) Ya que experimentalmente se ha observado aposición de cemento sobre la superficie resecada y este material de obturación. (43), (75) El objetivo final después de realizar una resección y obturación del extremo apical es lograr la cicatrización del aparato de inserción apical, la cual incluye la aposición de cemento sobre el material de obturación del extremo apical. (81) Ésta es una característica que pocas veces se ha observado en los materiales convencionales utilizados para tal fin, pero ha sido documentada en los estudios con MTA. (43), (75), (77), Torabinejad et al. (43) evaluaron en perros, la respuesta de los tejidos periapicales después de realizar cavidades en el extremo apical y obturarlas con MTA (Loma Linda University, Loma Linda CA) y amalgama. La evaluación histológica después de 10 y 18 semanas, evidenciaron que los casos obturados con MTA presentaban menor extensión y severidad de la inflamación, mayor aposición ósea y frecuente aposición de cemento sobre el material. En otro estudio también realizado por Torabinejad et al. (75) en perros, el examen histológico de los tejidos periapicales 5 meses después de haber realizado obturaciones del extremo apical con MTA (Loma Linda University, Loma Linda CA) y amalgama, se observó la formación de una capa completa de cemento sobre el MTA en todos los especímenes evaluados. También se evidenció ausencia de inflamación en el 83% de los casos obturados con este material. Al parecer la capacidad de sellado y adaptación marginal del MTA es superior a la amalgama, IRM® y SuperEBA®. (111) Aunque el mecanismo de formación del cemento sobre el MTA no está muy claro, al parecer, activa a los cementoblastos, lo que podría inducir la cementogénesis. (3), (77), (85) Por otro lado, Peters y Peters (112) realizaron una investigación para evaluar la adaptación marginal del SuperEBA® y el ProRoot® MTA gris (Dentsply/ Tulsa Dental, Tulsa, OK) cuando son utilizados en obturaciones del extremo apical y estudiar la frecuencia de microfracturas en la resección apical en dientes extraídos antes y después de someterlos a cargas oclusales por periodos de 5 años mediante una computadora que se encarga de controlar los movimientos masticatorios. Tomaron 24 molares humanos extraídos. Se prepararon y obturaron de forma convencional con gutapercha y sellador mediante compactación lateral. Se realizaron las cavidades apicales y se obturaron con los materiales en estudio. El procedimiento quirúrgico in Vitro fue realizado bajo el microscopio operatorio. Las resecciones obturaciones del extremo apical fueron evaluadas con microscopio electrónico de barrido antes y después de ser sometidos in Vitro a ciclos masticatorios mediante un simulador. La adaptación marginal y la integridad de los dos materiales de obturación apical fueron evaluados y se registró la presencia de microfracturas. Los resultados indicaron que antes de ser sometidos a las cargas oclusales, la adaptación marginal se observó en un 99,4% para el SuperEBA® y 92,2% para el MTA. Después de la carga, el porcentaje para el mismo parámetro decreció a un 93,1 y 98,9% para el SuperEBA® y MTA respectivamente. Después de la carga oclusal, el 39,5% de las raíces obturadas apicalmente con SuperEBA® se subobturaron, mientras que el 52,6% de las obturadas con MTA hubo sobreextensión. Un total de 12,5% de las raíces seccionadas en la superficie apical mostraron microfracturas antes de la carga y un 25% después, independientemente del material. Ambos materiales mostraron excelente adaptación marginal antes de ser sometidos a las cargas masticatorias. Después de aplicar las cargas, la continuidad del margen en ambos materiales se redujo ligeramente, pero sigue siendo elevada. Bajo las condiciones de este estudio ambos materiales mostraron resultados satisfactorios cuando son utilizados como materiales de obturación del extremo apical. Por su parte, Baek et al. (113) compararon la reacción periapical y la regeneración del cemento en contacto con la amalgama, SuperEBA® y ProRoot® MTA gris (Dentsply/ Tulsa Dental, Tulsa, OK) en dientes de perros utilizando un método de descalcificación. Tomaron molares y premolares de 7 perros. Se les removió el tejido pulpar, se colocaron puntas de papel contaminadas dentro de los conductos para inducir las lesiones periapicales y se sellaron con IRM® por 2 semanas. Las lesiones periapicales se formaron entre la 4ta y 6ta semana, siendo verificadas radiográficamente. Para ese momento, los dientes fueron tratados endodónticamente de forma convencional y las cavidades de acceso fueron selladas con IRM®. En la fase quirúrgica, se hicieron cavidades óseas de 4x4 mm de diámetro. Luego de la resección de cada raíz y la eliminación de la lesión perirradicular, se prepararon las cavidades en el extremo apical de 3mm con ultrasonido. Todos los procedimientos quirúrgicos se realizaron con el microscopio operatorio. Se resecaron 24 raíces, las cuales se dividieron en 3 grupos. El grupo A se obturaron los extremos apicales con amalgama, el grupo B con SuperEBA® y el grupo C con MTA. Los animales fueron sacrificados 4 meses después del procedimiento quirúrgico. Se realizaron los cortes que también abarcaron tejidos adyacentes, las muestras fueron preparadas para la evaluación histológica. Se evaluó la presencia de las células inflamatorias adyacentes a los materiales de obturación, además, se examinó el ligamento periodontal, la cicatrización ósea, y regeneración del cemento en los extremos apicales. Los resultados demostraron que el tejido adyacente al grupo del MTA presentó un menor grado de infiltrado de células inflamatorias, siendo principalmente células plasmáticas, linfocitos y algunos macrófagos. Con respecto al grupo del SuperEBA® se observó un número moderado de infiltrado de células inflamatorias, que incluía células plasmáticas, linfocitos, macrófagos y en algunos casos leucocitos polimorfonucleares. Mientras que los tejidos adyacentes con el grupo de la amalgama, mostró un marcado infiltrado de células inflamatorias, siendo estas polimorfonucleares, leucocitos, macrófagos y en algunos casos células gigantes, representando una diferencia significativa. El mayor grado de polimorfonucleares se observó con la amalgama, constituyendo una diferencia importante con el MTA, así como entre el MTA y el SuperEBA®. Gráfico Nº 50. 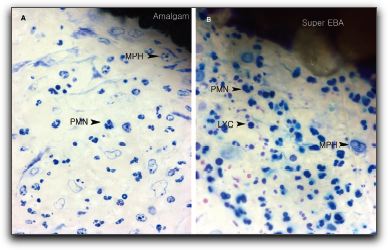
Cuando se evaluó el grado de inflamación de los materiales, el MTA y SuperEBA® mostraron menor reacción inflamatoria que la amalgama. Encontrándose una diferencia significativa entre la amalgama y el SuperEBA®, y la amalgama y el MTA. También se observó formación de cemento en 7 de nueve secciones del grupo del MTA, encontrándose también diferencia entre el MTA y los otros 2 materiales. Las cápsulas de tejido fibroso estuvieron presentes alrededor de los infiltrados inflamatorios en los grupos del SuperEBA y mayormente con la amalgama, no encontrándose en el grupo del MTA, siendo ésta otra diferencia significativa entre la amalgama y el MTA. Gráfico Nº 51. 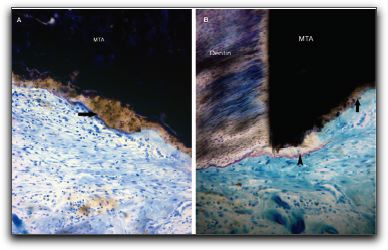
Las mayores diferencias encontradas en las respuestas de los tejidos periapicales entre los 3 materiales fueron el grado de inflamación y el tipo de infiltrado de células inflamatorias, la frecuencia de la cápsula fibrosa, la formación de cemento sobre estos materiales y el espesor del ligamento periodontal. El MTA mostró ser el mejor material, aunque el SuperEBA® fue mejor que la amalgama como material de obturación del extremo apical. Un hallazgo importante fue la formación de nuevo cemento que se produjo sólo con el grupo obturado con MTA, lo que sugiere que una barrera biológica en el ápice sólo puede obtenerse con el MTA. Sin embargo, durante la cirugía apical, existe el riesgo de contaminación durante la preparación del extremo apical por sangre, solución salina o la saliva, pudiendo afectar la capacidad de sellado del MTA. Por consiguiente, Montellano et al. (114) evaluaron si la contaminación del ProRoot® MTA blanco (Dentsply/ Tulsa Dental, Tulsa, OK) con sangre, solución salina o la saliva afecta su capacidad para prevenir la filtración de bacterias introducidas coronalmente. Utilizaron 90 dientes extraídos humanos monorradiculares, que fueron limpiados y preparados de forma estandarizada, hasta obtener un diámetro apical de .04 o un tamaño 50 con limas de niquel-titanio. Se realizaron las resecciones de los últimos 3 mm apicales y fueron preparadas las cavidades apicales. Los dientes se dividieron en 6 grupos de 15 dientes cada uno. El grupo 1, 2 y 3 fueron obturados con MTA después de contaminarlos con sangre, solución salina y saliva respectivamente. El grupo 4 fue obturado con MTA, sin contaminación y el grupo 5 y 6 constituyeron los grupos negativos y positivos. En el control negativo se colocó cera adhesiva cubriendo toda la raíz, y el control positivo, se colocó un cono único de gutapercha sin sellador a 1 mm de la raíz resecada. Se colocó el Staphylococcus epidermis en las cavidades de acceso coronario. El crecimiento fue evaluado después de 30 días y se demostró por medio de la turbidez del tubo donde fueron colocados los especímenes. Se utilizó el análisis de Vitek para confirmar la presencia del Staphylococcus epidermis. El análisis del porcentaje de filtración a los 30 días demostró que aunque los 4 grupos experimentales mostraron penetración bacteriana, las muestras de MTA sin contaminación, filtraron significativamente menos que los especímenes contaminados con saliva. No se encontraron diferencias significativas entre las muestras no contaminadas y los grupos contaminados con sangre y solución salina. Los resultados del presente estudio confirman los hallazgos para la formulación de color blanco del MTA, el sellado en presencia de sangre no difiere significativamente con el MTA sin presencia de contaminación. En este sentido, Saunders (115) realizó un estudio clínico prospectivo para evaluar el resultado de la cirugía perirradicular utilizando técnicas microquirúrgicas y ProRoot® MTA blanco (Proroot MTA White; Dentsply, Johnson City, TN) como material de obturación del extremo apical. Fueron incluidos para el estudio, 321 dientes tratados endodonticamente que no hubiesen cicatrizado. Se realizaron los procedimientos quirúrgicos correspondientes mediante un protocolo clínico estandarizado. Posteriormente fueron examinados periodicamente para evaluar signos y síntomas de fracaso. De la muestra inicial, sólo se puedo realizar los controles periódicos en 276 dientes, ya que los pacientes correspondientes a los 39 dientes restantes no acudieron a los controles. De los 276 dientes evaluados, 163 mostraron radiográficamente cicatrización completa y estaban asintomáticos, 82 dientes mostraron cicatrización incompleta o incierta e igualmente estaban asintomáticos y 31 dientes no mostraron cicatrización, 3 habían tenido dolor persistente a pesar que ren la radiografía se observó cicatrización completa y 8 dientes estaban dentro del grupo de no curados por motivos relacionados con el tratamiento quirúrgico. La tasa de éxito en general, fue 88,8%. En este estudio, el uso de MTA como material de obturación del extremo apical y técnicas microquirúrgicas, demostraron una alta tasa de éxito. (115) El procedimiento clínico descrito por Torabinejad y Chivian (5) para colocar el MTA en obturaciones del extremo apical es el siguiente: con un transportador pequeño colocar la mezcla dentro de la cavidad del extremo apical y compactarlo con un compactador pequeño. Debido a que el material gelifica en presencia de humedad, se debe crear cierta hemorragia del ligamento periodontal y el hueso y dejar la sangre sobre el extremo de la raíz resecada y el MTA y no lavar el campo operatorio después de colocarlo. 5.3. Como barrera apical para la inducción al cierre. Apicoformación La Asociación Americana de Endodoncistas en el Glosario de Términos Endodónticos define la apicoformación como un método para inducir una barrera calcificada en una raíz con ápice abierto o con un incompleto desarrollo radicular en dientes con pulpas necróticas. (97) El objetivo de este tratamiento es obtener una barrera apical para impedir el paso de toxinas y bacterias hacia los tejidos perirradiculares. Técnicamente, esta barrera también es necesaria para permitir la compactación del material de obturación. (116), (117) Es por ello, que el tratamiento de conducto constituye un reto importante porque el tamaño del conducto es amplio, sus paredes dentinarias son delgadas y frágiles y el ápice está bastante abierto. (117) Por consiguiente, varios materiales han sido utilizados como medicamentos intraconducto para la formación de esta barrera de tejido duro o como un tope apical para prevenir la extrusión de los materiales de obturación en dientes con ápices abiertos. (5) El hidróxido de calcio (Ca(OH)2) se ha convertido en el material de elección para la apicoformación. El alto pH del Ca(OH)2 puede inducir la actividad de la fosfatasa alcalina, y la presencia de una alta concentración de calcio puede incrementar la actividad de la fosfatasa calcio dependiente. A pesar de su popularidad para los procedimientos de apicoformación, la terapia con hidróxido de calcio tiene algunas desventajas inherentes que incluyen: la variabilidad en el tiempo del tratamiento, cierre apical impredecible, dificultad para el seguimiento de los pacientes, y el fracaso en el tratamiento. (8) Además, El problema más importante que se presenta con este procedimeinto mediante el uso del Ca(OH)2 es la duración de la terapia, que va de 3 a 21 meses. (118) Entonces, continúa la búsqueda para encontrar procedimientos y materiales que puedan permitir el cierre apical continuo en dientes con ápices inmaduros. Una alternativa de tratamiento a largo plazo para el procedimiento de apicoformación es el uso de una barrera artificial que permita la obturación inmediata del conducto. Shabahang et al. (8) realizaron un estudio comparativo para verificar la eficiencia de la proteína osteogénica-1 (OP-1), hidróxido de calcio y MTA gris (Loma Linda University, Loma Linda CA) en la formación de tejido duro en dientes de perro con desarrollo radicular incompleto. El MTA fue utilizado como barrera apical en premolares inmaduros de perros que fueron infectados a propósito y luego desinfectados con hidróxido de calcio. Los resultados mostraron que el MTA induce la formación de tejido duro con más consistencia y estaba asociado a menor inflamación que con los otros materiales. Basados en estos resultados el MTA puede ser utilizado como una barrera apical en dientes con ápices inmaduros. Así mismo, Torabinejad y Chivian (5) recomiendan el uso del MTA como barrera apical para inducir la formación de una barrera de tejido duro, previniendo así la extrusión del material de obturación en los casos de dientes con desarrollo radicular incompleto, o como barrera apical en dientes con pulpas necróticas y ápices abiertos. Otra técnica utilizada para procedimientos de apicoformación ha sido la combinación de la colocación de una barrera de MTA con la subsiguiente adhesión interna contra la barrera, que pueda disminuir el tiempo del tratamiento y aumentar el pronóstico a largo tiempo, es decir, el nuevo concepto de tratamiento implica la eliminación de la obturación de gutapercha, paso después de la apicoformación. El MTA colocado en el procedimiento de apicoformación, podría convertirse en el único material de obturación, preservando y restaurando el ápice abierto. En consecuencia la adhesión interna o dejar el espacio para la colocación del perno podría realizarse directamente sobre esta barrera. Por lo tanto, el objetivo del estudio realizado por Hachmeister et al. (119) fue investigar la validez de esta nueva técnica, mediante la evaluación de las propiedades de sellado y retención del MTA (Dentsply Tulsa Dental) cuando es colocado como barrera apical en un modelo in Vitro que simula estructuralmente el debilitamiento radicular y raíces divergentes de los dientes con ápices inmaduros. Tomando en cuenta que los fabricantes recomiendan que se debe colocar de 3-5 mm de espesor de MTA en el ápice para los procedimientos de apicoformación, se utilizaron 2 espesores diferentes, uno siguiendo las especificaciones (4mm) y otro considerablemente menor (1mm), por dos razones: la primera, la colocación a través de una cavidad de acceso con mínima resistencia en el ápice puede hacer el espesor un reto para el control. Y segundo, la cantidad colocada como una barrera va a determinar la profundidad máxima de adhesión que puede alcanzar cuando es internamente colocado en la raíz. Entre más grande es el espesor de la barrera presente, menor será la longitud de la raíz disponible para la adhesión. Los resultados mostraron que el espesor de MTA no tiene ningún impacto en la filtración pero sí influye significativamente en el desplazamiento de la resistencia. Los autores recomiendan que antes de la colocación del MTA los conductos sean medicados con hidróxido de calcio (Pulpdent, Pulpdent Corp., Watertown, MA) por 1 semana, con la subsiguiente remoción utilizando NaOCl e instrumentando los conductos, ya que también se evaluaron los efectos de los remanentes del hidróxido de calcio a lo largo de las paredes en la capacidad selladora de la gutapercha y el cemento sellador, encontrando una disminución significativa en la filtración de colorantes en los conductos medicados con hidróxido de calcio. Igualmente deducen que el hidróxido de calcio reacciona para formar carbonato cálcico proporcionando una disminución en la permeabilidad, pero con el tiempo el carbonato cálcico reabsorbible puede crear espacios en la interfase material-dentina. Sin embargo la medicación con hidróxido de calcio no tiene un efecto significativo en la filtración con el MTA o en el desplazamiento de la resistencia. Asumiendo que los remanentes de hidróxido de calcio en las paredes con ápices abiertos no afectan las propiedades del MTA. Sin embargo, estudios futuros se deben centrar en el perfeccionamiento de esta técnica para mejorar la capacidad de sellado del MTA como barrera apical, para que constituya una opción de tratamiento. (119) El mayor problema desde el punto de vista endodóntico que presentan los dientes inmaduros con ápices abiertos y pulpas necróticas es lograr un sellado adecuado. Anteriormente la terapia estaba destinada a inducir la formación de una barrera apical, de ahí que, Giuliani et al. (120) presentaron 3 casos clínicos. Todos eran incisivos centrales con desarrollo radicular incompleto causado por un trauma, y mostrando características clínicas y radiográficas de necrosis pulpar y periodontitis apical crónica. El primer caso se trataba de un niño de 13 años de edad, que sufrió un traumatismo hace 5 años en el incisivo central superior izquierdo. El examen clínico reveló una fístula con proximidad al ápice del diente, inflamación leve de la mucosa palatina, fractura incompleta de la corona, y movilidad dentro de los límites normales. El examen radiográfico mostró un ápice inmaduro, abierto, bastante amplio, y un área radiolúcida en proximidad con el ápice. Gráfico Nº 52. 
Se abordó el diente siguiendo los protocolos de aislamiento absoluto, irrigación y preparación, se colocó hidróxido de calcio (ultradent). A la semana, fue removido. Se colocó ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK, USA), se llevo al conducto utilizando un portaamalgama y con la ayuda del microscopio operatorio, se introdujo 4 mm del material en apical, para así crear la barrera. Se compactó con los compactadores de Schilder y se tomó radiografía control. Se colocó una torunda de algodón con agua estéril y la cavidad de acceso fue obturada con IRM®. Después de una semana, ambas se retiraron, se obturó el resto del conducto con gutapercha termoplastificada utilizando el sistema Obtura II como sellador Pulp Canal Sealer® (Kerr). El diente fue restaurado con una resina compuesta. El control radiográfico a los 6 meses mostró una disminución de la rarefacción periapical y la imagen radiolúcida había desaparecido. El control clínico al año, mostró ausencia total de signos y síntomas previos. Gráficos Nº 53 y 54.  
El segundo caso, se trataba de un niño de 15 años de edad, que sufrió un traumatismo a los 9 años en el incisivo central superior derecho. El diente estaba asintomático al momento de la consulta. El examen clínico reveló una fístula por vestibular, movilidad fisiológica y un ligero cambio de color. Al examen radiográfico se observó un ápice abierto y una imagen radiolúcida en apical. Gráfico Nº 55. 
Se creó una barrera apical con MTA como en el caso anterior, siguiendo el mismo protocolo de aislamiento absoluto, irrigación, instrumentación, preparación, colocación de MTA y restauración coronaria. Al examen clínico luego de 6 meses y 1 año de control mostró ausencia de movilidad, dolor y fístula. La evaluación radiográfica a los 6 meses reveló una reducción del área radiolúcida. Posteriormente al año, se observó una disminución mayor de la imagen. Gráficos Nº 56, 57.  
El tercer caso, se trataba de una paciente femenina de 27 años de edad, que presentaba una fístula en proximidad con el incisivo central superior derecho con tratamiento de conducto previo. El examen radiográfico mostró una imagen radiolúcida periapical y el ápice estaba abierto. Hace 10 años le habían realizado una apicoformación, la cual había fracasado. Luego de eliminar la gutapercha, en una segunda sesión se colocó MTA siguiendo el mismo protocolo del primer caso. Durante el seguimiento clínico a los 6 meses y al año, se observó ausencia de síntomas clínicos y ausencia de movilidad. Gráficos Nº 58, 59 y 60.  
Gráfico Nº 60. Rx al año de control postoperatorio. Tomado de Giuliani et al. 2002. 120 De acuerdo con los autores, Los casos clínicos presentados demuestran que cuando se utiliza el MTA como barrera apical en dientes necróticos con ápices inmaduros, el conducto podría ser perfectamente sellado con este material. Los controles clínicos y radiográficos en los tres casos mostraron cicatrización de las lesiones periapicales y formación de nuevo tejido duro en la zona apical. El MTA perece ser una opción válida para las apicoformaciones, representando una ventaja en el tiempo que llevaría la terapia convencional. Sería apropiado realizar estudios longitudinales, con una muestra mayor, para determinar el éxito de esta terapia. El siguiente caso clínico presentado por Hayashi et al. (121) muestra el uso del MTA como material de obturación para promover la cicatrización periapical de los conductos radiculares con ápices abiertos como consecuencia de terapias endodónticas anteriores. Se trataba de un paciente masculino de 58 años de edad, refiriendo que hace 13 años, los dos incisivos centrales inferiores fueron tratados endodónticamente y restaurados con coronas metal porcelana, y que posteriormente le realizaron una cirugía periapical, resultando en el fracaso clínico. A la evaluación clínica se observó una fístula por vestibular a nivel de los ápices de ambos dientes, acompañado de edema. El examen radiográfico reveló pernos intrarradiculares ocupando aproximadamente la longitud de la raíz, obturaciones de los conductos deficientes y una imagen radiolúcida perirradicular en ambos dientes. Se le explicó al paciente que la cirugía perirradicular era la mejor opción para lograr el sellado apical y promover la cicatrización de la zona, sin tomar el riesgo de fracturar la raíz durante la remoción de las restauraciones definitivas. Sin embargo, el paciente decidió tomar el riesgo de realizar el tratamiento por vía convencional, repitiendo el tratamiento utilizando MTA como material de obturación apical después de remover las restauraciones con los respectivos pernos. Los pernos fueron removidos con cuidado para evitar la fractura radicular, se eliminó el material de obturación, con la ayuda del localizador apical se determinó la longitud de trabajo, se tenía dificultad debido a que los ápices estaban abiertos y ambas con resección apical. Los conductos fueron limpiados y preparados, se les colocó hidróxido de calcio y se realizó un recambio a las 2 semanas. Para ese momento, ya no había fístula y ningún síntoma asociado, la porción apical del conducto fue obturada con MTA, con la premisa que formara una barrera apical artificial y promoviera la cicatrización de los tejidos perirradiculares. El espesor de MTA fue de 3 a 4 mm en la porción apical después de preparar el espacio para los pernos. No se colocó gutapercha luego de colocar la barrera de MTA. Se realizaron controles postoperatorios y a los 2 años se observó la regeneración periapical de los tejidos. Gráficos Nº 61 y 62.  
En este caso, los autores consideraron el uso del MTA como una estrategia efectiva para crear un sellado apical artificial del ápice el cual tenía una morfología irregular y esto representaba una dificultad para lograr un sellado adecuado en condiciones húmedas. Además confirman que el MTA no sólo sirve de barrera apical en los casos de apicoformación, sino también como barrera en los casos de fracasos de sistemas de conductos infectados. Al igual que su capacidad de sellado es superior bajo condiciones de humedad fue un elemento esencial para la cicatrización de los 2 dientes. Por lo tanto, el MTA puede ser considerado como un material eficaz para promover la cicatrización de los tejidos periapicales, aún en dientes infectados con ápices abiertos. (121) Por otro lado, Felippe et al. (122) evaluaron el efecto del ProRoot® MTAgris (Dentsply Tulsa Dental, Tulsa, OK, USA) en la apicoformación y cicatrización apical en dientes de perros con raíces incompletamente formadas y conductos contaminados, y verificar si es necesario colocar hidróxido de calcio en pasta (pure calcium hydroxide, 0.612 mg, Reagen, Rio de Janeiro, RJ, Brazil) previo al uso del MTA. Utilizaron 40 conductos de 20 premolares de 2 perros de 6 meses. Una vez realizadas las aperturas y la remoción completa de la pulpa, los sistemas de conductos fueron expuestos al medio bucal por 2 semanas. Posteriormente, se prepararon con limas Hedstrom e irrigados con NaOCl al 1%. Luego que fueron secados los conductos, 2 premolares de cada perro se dejaron vacíos para que sirvieran como grupo control. Los otros 8 dientes de cada animal fueron divididos en 2 grupos experimentales. En el grupo 1 los tercios apicales se obturaron con MTA, y el grupo 2 con hidróxido de calcio mezclado con propilenglicol. Después de una semana la pasta de hidróxido de calcio fue removida y el tercio apical se obturó con MTA. Todos los dientes fueron restaurados con IRM® y amalgama. Los animales fueron sacrificados después de 5 meses. Los dientes y los tejidos adyacentes fueron cortados en bloque, y se procesaron para el análisis histológico. Las secciones fueron analizadas para evaluar 7 parámetros: formación de una barrera apical de tejido duro, nivel de formación de la misma, reacción inflamatoria, resorción ósea y radicular, extrusión de MTA y presencia de microorganismos. Los resultados demuestran que se encontraron diferencias significativas en relación con la posición de la barrera y la extrusión del material. La barrera se formó en el interior de los conductos en un 69,2% en el grupo con MTA. En el grupo 2, se formó más allá de las paredes del conducto en un 75% de las raíces. La extrusión del MTA ocurrió principalmente en las raíces del grupo 2, en un 75% ya que para el grupo 1 fue en un 7,7%. Con respecto a los otros parámetros hubo similitud entre los grupos, es decir, la formación de la barrera apical de tejido duro estuvo presente en todos los especímenes de ambos grupos, en un 53,8% en el grupo 1 y 16,7% en el grupo 2. Con respecto a la reacción inflamatoria se observó una inflamación crónica en un 30,8% y 58,3% para los especímenes del grupo 1 y 2 respectivamente, no encontrándose diferencias significativas entre los grupos. La resorción ósea fue observada en un 23,1% en las raíces del grupo 1 y 25% en las raíces del grupo 2, la resorción radicular se observó en un 23,1% para los especímenes del grupo 1 y 33% para los del grupo 2, y no se encontraron microorganismos en ninguno de los grupos. Este estudio demostró que la aplicación del MTA inmediatamente después de la preparación del conducto favoreció el restablecimiento del ligamento periodontal y la formación de hueso nuevo y cemento. El MTA tuvo un comportamiento similar al hidróxido de calcio en pasta, incluso en presencia de exudado y contaminación observada en el momento de la preparación, logrando así la desinfección del conducto y estimulando la formación de una barrera apical de tejido duro. Por ende, el MTA puede ser utilizado después de la preparación del conducto a favor de la apicoformación y cicatrización periapical. El uso del hidróxido de calcio en pasta antes del uso del MTA no es necesario para que ocurra la apicoformación y ha demostrado estar relacionado directamente con la extrusión de este material y la formación de la barrera más allá de los límites de las paredes de los conductos. (122) Adicionalmente, Simon et al. (117) realizaron un estudio prospectivo para determinar la efectividad del ProRoot® MTA blanco (Dentsply Maillefer, Ballaigues, Switzerland) en la apicoformación realizada en una cita, mediante la evaluación de 50 pacientes que habían recibido este tipo de tratamiento. Tomaron 57 dientes con ápices abiertos de 50 pacientes referidos, los cuales se les realizaron tratamientos de apicoformación en una cita por el mismo operador. Se realizaron controles postoperatorios a los 6 meses, 12 meses y luego cada año, desde el 2001 hasta el 2005. Se logró realizar controles postoperatorios a los 12 meses en 43 casos. Observando que la cicatrización ocurrió en el 81% de los casos. En consecuencia, la apicoformación en una sola cita utilizando MTA como barrera apical puede considerarse como un tratamiento previsible, y puede ser una alternativa a la utilización del hidróxido de calcio. (117) Por su parte Torabinejad y Chivian (5) recomendaron utilizar en MTA como barrera apical en dientes con pulpas necróticas y ápices abiertos llevando a cabo el siguiente procedimiento clínico: después de anestesiar, y aislar de forma absoluta el diente, y preparar un acceso adecuado, el sistema de conductos radiculares, se debe desinfectar instrumentando e irrigando con NaOCl. Para completar la desinfección del conducto, se introduce el hidróxido de calcio como medicamento intraconducto por una semana. Después de irrigar el conducto con NaOCl y eliminar el hidróxido de calcio, se seca con puntas de papel, se mezcla el polvo del MTA con agua estéril y se lleva la mezcla con un portaamalgama grande al conducto. Posteriormente, se compacta el MTA hacia el ápice de la raíz con compactadores o puntas de papel, creando una barrera apical de MTA de 3 a 4 mm y verificar su extensión radiográficamente. Si la obturación de la barrera apical falla en el primer intento se debe lavar el MTA con agua estéril y repetir el procedimiento. Colocar una torunda de algodón húmeda en el conducto y cerrar el acceso preparado de la cavidad con un material de obturación provisional por lo menos de tres a cuatro horas. Obturar el resto del conducto con gutapercha o con resina en dientes con paredes delgadas como está indicado, y sellar la cavidad de acceso con una restauración definitiva. Evaluar y valorar la cicatrización apical clínica y radiográficamente. 5.4. Terapia de pulpas vitales El objetivo de la terapia pulpar conservadora es mantener el tejido pulpar coronal y radicular en una condición viable. Para lograr este objetivo, el tejido pulpar expuesto al medio bucal debe ser protegido para preservar su vitalidad. (123) Los procedimientos más comunes en la terapia de pulpas vitales es el recubrimiento pulpar directo y la pulpotomía, los cuales están indicados solamente cuando las pulpas dentales son expuestas y en casos de dientes con ápices inmaduros, donde la vitalidad pulpar debe ser preservada. Estos procedimientos están contraindicados en dientes con signos y síntomas de pulpitis irreversible. (5) 5.4.1. Recubrimiento pulpar directo La Asociación Americana de Endodoncistas en el Glosario de Términos Endodónticos define el recubrimiento pulpar directo como la colocación de un material adecuado sobre la pulpa vital expuesta por un daño mecánico o traumático. (97) Ainehchi et al (124) señalan que el procedimiento de recubrimiento pulpar se basa principalmente en la capacidad del tejido pulpar para repararse. Varios factores afectan éste proceso incluyendo, la edad, la condición periodontal y el estadío de formación radicular. Factores durante el procedimiento tales como el tamaño de la exposición, su naturaleza (traumática, mecánica o bacteriana) y la contaminación microbiana del sitio, han sido descritos como determinantes en el éxito del recubrimiento pulpar. De igual manera, Swift et al. (125) mencionan que otro factor que influye en el resultado del recubrimiento pulpar, es el control adecuado de la hemorragia, el cual es fundamental para el éxito de éste tratamiento para el recubrimiento pulpar, independientemente del material utilizado. La reparación de las exposiciones pulpares no dependen del material de recubrimiento, pero sí está relacionado con la capacidad de estos materiales para evitar la filtración bacteriana, y por otro lado también depende de las condiciones de asepsia en las que se realiza este tipo de procedimiento. (5) Un puente dentinario puede ser un signo de reparación o de irritación, y es conocido que la presencia de bacterias es un factor determinante en la inhibición de la reparación de las exposiciones pulpares. Desafortunadamente, el hidróxido de calcio no se adhiere a la dentina y pierde su capacidad de sellado. Defectos en los puentes de dentina bajo el recubrimiento con hidróxido de calcio pueden actuar como vías para la microfiltración. (124) Diferentes formulaciones de hidróxido de calcio se han utilizado para dicho procedimiento, sin embargo, estos materiales no son capaces de sellar el tejido pulpar del medio externo. Tienden a disolverse y desintegrarse con el tiempo, dejando espacios y vías de comunicación para la posible microfiltración bacteriana. (126) Otras desventajas atribuídas al mismo, es la formación de dentina obliterando la cámara pulpar, su alta solubilidad a los fluidos y la falta de adherencia y adhesión después del grabado ácido. (127) Debido a que el MTA ha demostrado que previene la filtración bacteriana (3), (43), además de tener un alto nivel de biocompatibilidad, fue utilizado por primera vez, como material de recubrimiento pulpar en pulpas de monos expuestas mecánicamente, en un estudio realizado por Pitt Ford et al. (74). Los resultados demostraron que el MTA estimula la formación de un puente de dentina adyacente a la pulpa, mostrando un comportamiento superior al hidróxido de calcio. La dentinogénesis del MTA puede ser debida a su capacidad de sellado, biocompatibilidad, alcalinidad y posiblemente a otras propiedades asociadas a este material. En este sentido, Koh et al. (128) reportaron 2 casos para presentar el uso del MTA gris (Dentsply/ Tulsa Dental, Tulsa, OK) en lugar del hidróxido de calcio como material de recubrimiento pulpar para el tratamiento profiláctico de un dens evaginatus en 2 pacientes. Cada paciente tenía un segundo premolar inferior izquierdo con un tubérculo prominente. Se realizó la pulpotomía parcial en ambos. Una vez realizada la apertura con dique de goma y demás normas de asepsia, la hemorragia fue controlada. El MTA fue preparado de acuerdo a las indicaciones del fabricante, se colocó directamente sobre la pulpa, cubriendo toda la cavidad de acceso. Los pacientes se evaluaron a los 2 días. El MTA se rebajó y se colocó una resina compuesta. Estos dientes posteriormente serán extraídos por razones ortodónticas. A los 6 meses se evaluaron radiográficamente. Gráficos Nº 63 y 64.  
Los dientes extraídos, se desmineralizaron, deshidrataron, seccionaron y fueron teñidos para la evaluación histológica. Ambos dientes mostraron deposición de un puente dentinario debajo del MTA. No hubo inflamación pulpar. Los resultados positivos en ambos casos clínicos, demuestra que el MTA se puede utilizar como material en los recubrimientos pulpares dierctos de forma profiláctica en el tratamiento del dens evaginatus, como una alternativa a los materiales existentes, como el hidróxido de calcio. Adicionalmente, Tziafas et al. (129) estudiaron la respuesta pulpar celular temprana y la formación de dentina reparadora después de utilizar ProRoot® MTA gris (Dentsply/ Tulsa Dental, Tulsa, OK) como recubridor en exposiciones pulpares mecánicas. Para ello, utilizaron 33 dientes de perros, de 12 y 18 meses de edad, se realizaron exposiciones mecánicas clase V. Se colocó el material en el sitio de la exposición, previo control de la hemorragia y se dejó una torunda de algodón húmeda. Las cavidades fueron restauradas con amalgama y se evaluó la reacción del tejido pulpar a través del microscopio electrónico de transmisión. Los períodos de evaluación fueron a la 1, 2 y 3 semanas respectivamente. Los animales fueron sacrificados, y los dientes deshidratados y fijados para la evaluación. Los resultados demostraron que el recubrimiento pulpar con MTA produce cambios citológicos y funcionales de las células pulpares, resultando en la producción de dentina reparativa sobre la superficie de una pulpa expuesta mecánicamente. Ofreciendo un sustrato biológicamente activo para las células pulpares, necesario para regular los eventos dentinogénicos. El efecto inicial del MTA sobre la superficie de la pulpa expuesta mecánicamente es la formación de una capa de estructura cristalina. Esta reacción inmediata indica la estimulación de la actividad biosintética de las células pulpares por el recubrimiento, pero no puede ser caracterizada como una inducción directa de la formación de dentina reparativa. Una nueva matriz de formas atubulares con inclusiones celulares fueron observadas debajo del material a las dos semanas. Al evaluarlo bajo microscopio electrónico de barrido se encontraron fibras colágenas, las cuales están en contacto directo con la capa cristalina superficial. La dentinogénesis reparativa se obtiene claramente a las tres semanas del recubrimiento, asociada con una matriz fibrodentinal. Por lo tanto el MTA es un material efectivo para el recubrimiento pulpar directo, ya que favorece la formación de un puente de tejido duro durante el proceso de reparación, teniendo en cuenta que el procedimiento sea realizado bajo una total asepsia. Por su parte, Parirokh et al. (130) compararon el ProRoot® MTA (Dentsply, Tulsa Dental, Tulsa, OK, USA) en sus 2 presentaciones gris y blanco cuando son utilizados en el recubrimiento pulpar en perros. Utilizaron 24 dientes de 4 perros machos entre 18 y 24 meses de edad. Con todas las normas de asepsia, se realizaron las exposiciones pulpares con una fresa número 1. Todas las exposiciones fueron estandarizadas, teniendo 1 mm de diámetro.la hemorragia fue controlada, ambos materiales se prepararon de acuerdo con las instrucciones del fabricante y se colocaron en el sitio de la exposición. El análisis histológico se realizó a la 1 y 2 semana. Los resultados a la primera semana mostraron que 4 dientes sellados con ProRoot® MTA blanco y 3 con MTA gris, presentaban una fina capa de tejido calcificado. Ninguno mostró necrosis cerca del sitio de la exposición. Se observaron células odontoblásticas en la periferia del puente calcificado. El puente era amorfo y no tubular y también se pudo evidenciar una leve inflamación y algunos macrófagos y linfocitos. No se encontraron diferencias significativas entre ambas presentaciones. A las 2 semanas se observó que todos los especímenes de ambas presentaciones de MTA, a excepción de 2 muestras de MTA gris, mostraron completa formación de un puente dentinario debajo del sitio de la exposición. El espesor del puente había aumentado, se observaron igualmente células inflamatorias pero en menor número que a la primera semana. Con ambas presentaciones se observaron zonas de resorción y deposición de dentina. La falta de diferencia en la formación de los puentes calcificados entre las dos presentaciones de MTA en este estudio, comprueba que ambos, permiten un mínimo de microfiltración. Adicionalmente, Asgary et al. (131) observaron en su estudio la morfología básica y la composición química del puente dentinario adyacente al ProRoot® MTA blanco (Dentsply, Tulsa Dental, Tulsa, OK, USA) cuando se utiliza como recubridor pulpar directo. El procedimiento experimental se realizó en 7 dientes caninos de 3 perros. La metodología de la exposición pulpar fue igual al estudio anterior. A las 2 semanas los perros fueron sacrificados para la evaluación histológica de los especímenes por medio del microscopio electrónico de barrido. Los resultados arrojaron la presencia de MTA blanco en el espacio pulpar. Los cristales de este material estaban en contacto directo con las células odontoblásticas y fibras colágenas. Los puentes dentinarios presentaron 3 aspectos diferentes: un aspecto exterior compuesto por MTA blanco en contacto directo con fibras extracelulares y procesos odontoblásticos. La parte media estaba constituída por una malla gruesa de fibras extracelulares (colágeno), que fue identificada como una matriz orgánica que contiene abundantes centros de calcificación, y en el interior de la pulpa se observó una estructura no dentinaria con túbulos irregulares. En base a los resultados de este estudio, para el control de situaciones clínicas como ésta, el ProRoot® MTA blanco puede ser considerado como un material adecuado de recubrimiento pulpar directo para la protección de la pulpa, estimulando la formación de un puente dentinario. En el caso del recubrimiento pulpar directo, el control de la hemorragia es un factor importante para el éxito. Se sabe poco acerca del efecto del MTA sobre el sangramiento pulpar, es por ello que Tunca et al. (132) en su estudio al evaluar los efectos vasculares del ProRoot® MTA gris (Dentsply, Tulsa Dental, Tulsa, OK, USA), en modelos de tejido de la aorta de ratas, determinaron que el efecto contráctil del MTA fue bloqueado por los canales de calcio, lo cual sugiere que la propiedad vasoconstrictora del material que está relacionada con la liberación del calcio, por lo que puede permitir un control adecuado de la hemorragia, lo cual es fundamental para el éxito de cualquier tratamiento de recubrimiento pulpar. Por otra parte, Accorinte et al. (133) compararon las características histomorfológicas del MTA gris (Dentsply Caulk, Milford, DE) y un cemento de hidróxido de calcio (Life, Kerr, Romulus, MI) después de 30 y 60 días, con la hipótesis de que ningún material presentaba diferencias significativas cuando eran utilizados en el recubrimiento pulpar durante los 2 períodos de evaluación. Tomaron 40 dientes humanos premolares de pacientes entre 15 y 30 años de edad, los cuales posteriormente serian extraídos una vez terminado el estudio por razones ortodónticas. Se realizaron las exposiciones pulpares con las debidas normas de asepsia, se colocaron los respectivos materiales y se restauraron con resina. Se dividieron en 4 grupos: grupo 1 y 2 estaban representados por el hidróxido de calcio para ser evaluados a los 30 y 60 días respectivamente, y el grupo 3 y 4 estaban formados por el MTA para igual períodos de evaluación. Posterior a los 30 y 60 días, los dientes fueron extraídos y procesados para el examen histológico. Los resultados demostraron que todos los grupos tenían buenos resultados en términos de formación de un puente de tejido duro y respuesta inflamatoria. Sin embargo, una respuesta inferior fue observada en el grupo del hidróxido de calcio evaluado a los 30 días, en la formación del puente, en comparación con los grupos del MTA en los 2 períodos. Además, el grupo del hidróxido a los 30 días también fue inferior al del MTA en el mismo peíiodo de tiempo, en el resultado del alto porcentaje de partículas de hidróxido de calcio en el interior del tejido pulpar. No se reportó sensibilidad postoperatoria durante todo el estudio. Aunque la cicatrización pulpar con el hidróxido de calcio fue más lenta que con el MTA, ambos materiales fueron exitosos en el recubrimiento pulpar en dientes humanos. Los resultados de este estudio deben ser cuidadosamente evaluados, ya que el procedimiento de recubrimiento se llevó a cabo en dientes sanos. En la mayoría de las condiciones clínicas, la exposición pulpar con frecuencia es producto de un proceso carioso, donde el nivel de inflamación es mucho mayor. Lo ideal sería realizar estudio con la condición clínica más real, para verificar la reproductibilidad de los resultados de esta evaluación clínica. Sin embargo, las características histomorfológicas de este estudio apoyan el hecho de que el MTA puede utilizarse de manera segura en el recubrimiento pulpar. Con el uso del MTA los tejidos cicatrizan de una manera más rápida que con el cemento de hidróxido de calcio, aunque después de los 60 días, ambos materiales muestran resultados exitosos cuando son empleados como recubridores pulpares en dientes humanos. El procedimiento clínico recomendado para los recubrimientos pulpares directos y pulpotomías en dientes con ápices inmaduros es el siguiente: después de anestesiar y aislar absoluto con dique de goma, lavar la cavidad y el sitio de la exposición pulpar con NaOCl diluido. En casos de pulpotomías, la pulpa coronaria debe ser removida con una fresa larga de diamante con refrigeración continua a baja velocidad. El sangrado en el sitio de la exposición puede ser controlado con una torunda de algodón impregnada con NaOCl, mezclar el polvo del MTA con agua estéril y colocar la mezcla en la cavidad de acceso con un porta-amalgama plástico grande. Llevar el material al sitio de la exposición con una torunda de algodón húmeda, luego colocar una torunda de algodón seca sobre el MTA y rellenar el resto de la cavidad con un material de obturación temporal. Con el consentimiento del paciente rellenar toda la cavidad con MTA, colocando una gasa húmeda entre el diente tratado y el diente antagonista, e indicarle al paciente que evite masticar por ese lado de 3 a 4 horas. (5) Como el MTA tiene una fuerza compresiva baja y no puede ser usado como material de obturación permanente, éste debe ser removido una semana después, eliminando sólo de 3 a 4 mm y se coloca la restauración definitiva sobre el MTA. Se recomienda hacer un exámen clínico, radiográfico y de la vitalidad pulpar de 3 a 6 meses según sea necesario. El tratamiento de conductos podrá o no realizarse, dependiendo de su necesidad. (5) 5.4.2. Pulpotomías vitales En el Glosario de Términos de la Asociación Americana de Endodoncistas definen la pulpotomía como la remoción quirúrgica de la pulpa vital de la porción coronaria con la finalidad de preservar la vitalidad del remanente pulpar en la porción radicular, y también puede ser llevado a cabo como un procedimiento de urgencia de forma temporal para el alivio de los síntomas o como medida terapéutica, como es el caso de una pulpotomía parcial. (97) En este sentido, Naik y Hedge (134) presentaron un estudio donde evaluaron el MTA en pulpotomías realizadas en molares temporales, determinando si era efectivo cuando es evaluado clínica y radiográficamente por un período de 6 meses. Utilizaron 50 dientes molares temporales de niños. Se realizaron las pulpotomías de forma convencional. Se colocó formocresol en 25 dientes, constituyendo así el grupo control y se restauraron coronalmente con IRM®. A los otros 25 dientes se les colocó MTA (grupo experimental), el cual se preparo en proporción 3:1 hasta obtener una consistencia pastosa y se colocó una bola de algodón húmeda. Se restauró coronalmente con IRM®. Posteriormente los pacientes fueron evaluados clínica y radiográficamente al mes, 3 meses y 6 meses. Ninguno de los dientes mostró signos patológicos, ni al examen clínico ni radiográfico, durante los 3 períodos de evaluación. El formocresol es considerado como un material adecuado para la terapia pulpar en dientes temporales, pero se ha reportado que es tóxico, mutagénico y cariogénico La única diferencia encontrada fue la decoloración observada en un 60% de los dientes cuando el MTA fue utilizado como medicamento después de 24 horas. Por otro lado, Barrieshi-Nusair y Qudeimat (135) evaluaron el éxito del ProRoot® MTA gris y blanco (Dentsply, Tulsa Dental, Tulsa, OK, USA) utilizándolos en el tratamiento de pulpotomías parciales superficiales en exposiciones pulpares por caries. Incluyeron en el estudio, 31 dientes de 23 pacientes jóvenes con un rango de edad entre 7,2 y 13,1, sólo primeros molares permanentes con lesiones cariosas que resultaran en una exposición pulpar, y que no hubiesen tenido episodios de dolor prolongado o espontáneo. Al examen clínico, todos los dientes respondieron de forma normal a las pruebas diagnósticas. Radiográficamente se observó completa normalidad de los tejidos periapicales, por lo que el diagnóstico fue de pulpitis reversible para todos los dientes. Bajo todas las normas de asepsia, se procedió a eliminar la caries en todos los dientes, con una fresa redonda y cucharitas de dentina. La exposición superficial del tejido pulpar fue eliminado cuidadosamente y se irrigo para controlar la hemorragia con solución salina. Se preparó el material de acuerdo a las instrucciones del fabricante. Se colocó una capa de 2 a 4 mm del material sobre la exposición. La cavidad fue cubierta con Vitrebond® (3M), se colocó una base de vidrio ionomérico y restaurados con amalgama. Los dientes se evaluaron clínica y radiográficamente a los 3, 6, 12 y 24 meses respectivamente. Al final de este período, el tratamiento era considerado fracasado si una o más de las siguientes características estaban presentes: dolor, edema, tracto sinusal, molestia a la percusión, patología perirradicular o en furca y resorción radicular. Además de la falta en la continuación del desarrollo radicular en dientes inmaduros. Los resultados obtenidos se mostraron en base a 21 pacientes con 28 dientes para la evaluación, ya que el resto no volvió para el seguimiento del tratamiento. 22 dientes (79%) respondieron normal a las pruebas diagnósticas y no mostraron clínica ni radiográficamente signos de fracaso, mientras que 6 dientes no respondieron a las pruebas, sin embargo, no manifestaron dolor a la percusión ni a la palpación. Radiográficamente ningún diente mostró signos patológicos. En 18 casos (64%) se observó por medio de la radiografía un puente de tejido duro, y 7 dientes que tenían los ápices abiertos en el inicio del tratamiento, mostraron la continuación del desarrollo radicular, Gráfico Nº65. 
Los autores mencionan, que en lugar de realizar un tratamiento de conductos a edad temprana, tal vez la pulpotomía parcial sea la mejor opción de tratamiento. En dientes inmaduros se logra mantener la vitalidad pulpar en la porción radicular. En este estudio la pulpotomía parcial fue una técnica viable, siendo el MTA un material adecuado para cumplir con dicho objetivo. 5.5. Otros usos Ya que el MTA provee un sellado efectivo contra la penetración de colorantes y bacterias y sus metabolitos como endotoxinas, también puede ser utilizado como material de sellado coronario (3-4mm) después de completar la obturación de los conductos radiculares y antes de realizar blanqueamientos intracoronarios. (5) Se introduce la mezcla del MTA de 3 a 4 mm de espesor en la cavidad preparada, se coloca una torunda de algodón húmeda sobre la mezcla y se rellena el resto de la cavidad con un material de obturación temporal. Después de 3 o 4 horas, se remueve el material de obturación temporal y se podrá obturar permanentemente cuando esté indicado. (5) Otro uso es como material de obturación temporal, se coloca una torunda de algodón en la cámara pulpar, y se rellena el resto de la cavidad de acceso con MTA colocando una gasa húmeda entre la superficie oclusal del diente y el diente adyacente. Se le debe informar al paciente que no debe morder por ese lado de 3 a 4 horas y posteriormente remover los excesos de MTA con una fresa redonda en la próxima cita. (5) Para la reparación de una fractura vertical, se debe remover el material de obturación del diente y se deben unir las superficies internamente con resina. Después de levantar un colgajo o de extraer el diente para un reimplante intencional se debe hacer una cavidad sobre toda la superficie de la fractura con una fresa pequeña bajo irrigación constante, colocar el MTA sobre la superficie, cubrir con una membrana reabsorbible y luego suturar el colgajo. Para mejorar el pronóstico en estos casos el paciente debe ser instruído para seguir una higiene bucal meticulosa. A pesar del éxito en algunos casos en la reparación de fracturas verticales, donde el material esté en contacto directo con la cavidad bucal por un largo período de tiempo, es impredecible. Esto es debido al hecho de que el MTA se disuelve en un pH ácido. (5)
III.- DISCUSIÓN El Agregado Trióxido Mineral es un polvo que consiste en finas partículas hidrofílicas que forman un gel coloidal en presencia de agua que solidifica a una estructura dura aproximadamente en 4 horas. (5) Es un derivado del Cemento de Portland. (10) Adicionalmente del MTA (Loma Linda University, Loma Linda CA) se encuentra comercialmente disponible 3 marcas comerciales de MTA: ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) en 2 presentaciones, de color gris, introducido en 1998 y blanco introducido en el año 2002, MTA Angelus® (Angelus Soluçöes Odontológicas, Londrina, Brazil) en 2 presentaciones, de color gris y blanco introducido en el año 2001, (11), (12), y más recientemente, en el 2004, fue desarrollado en Argentina el CPMTM (Egeo S.R.L., Buenos Aires, Argentina). (13) Los principales componentes presentes en la presentación gris del MTA (Loma Linda University, Loma Linda CA), ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) y CPMTM (Egeo S.R.L., Buenos Aires, Argentina) son el silicato tricálcico, aluminato tricálcico, óxido tricálcico, óxido de silicato, sulfato de calcio. Además contienen en menor medida óxido de bismuto, el cual es el responsable de darle la radiopacidad adecuada al material. (4), (12) (22) Las principales moléculas presentes son los iones de calcio y fósforo, los cuales le proporcionan al MTA excelente biocompatibilidad cuando está en contacto con las células y los tejidos. (4) Recientemente, el fabricante del ProRoot MTA® (Dentsply Tulsa Dental, Tulsa, OK) describió que el material está compuesto por 75% de PC, 20% de óxido de bismuto y 5% de sulfato de calcio dihidratado. (12) De acuerdo con el fabricante, el MTA Angelus® (Angelus Soluçöes Odontológicas, Londrina, Brazil) contiene en su composición 80% de PC y 20% de óxido de bismuto. No posee en su fórmula sulfato de calcio, con la finalidad de reducir el tiempo de gelificación. (10) El MTA blanco se ha desarrollado y comercializado para sustituir el MTA gris cuando existe un compromiso estético, por lo que en su contenido tiene una reducción significativa en la proporción del componente ferroaluminato tetracálcico, siendo la ausencia de este componete la causa principal de su color. (13), (15), (17) En la literatura existen una serie de estudios que se han realizado con esta presentación para determinar si posee las mismas propiedades y composición química que el MTA gris. Los estudios comparativos entre ambos, han dado resultados contradictorios en términos de biocompatibilidad, capacidad de sellado y la propiedad de inducir la regeneración de los tejidos. (16) Estos estudios han demostrado que los principales óxidos predominantes en ambos tipos de MTA son el calcio, sílice y óxido de bismuto respectivamente (73% en el gris y 82% en el blanco). Las mayores diferencias se encuentran en las concentraciones de trióxido de aluminio, óxido de magnesio y especialmente en el óxido de hierro, siendo la concentración de estos considerablemente menor en el MTA blanco. (17) (18) El MTA blanco no contiene entre sus componentes el hierro, no engloba las grandes partículas del MTA gris, que son importantes para el manejo de sus propiedades clínicas. (18) Teniendo en cuenta que el MTA está compuesto por un 75% de PC, algunos estudios comparativos entre el PC y el MTA han demostrado que no existen diferencias significativas entre los 14 elementos químicos presentes en ambos materiales,siendo sus principales componentes fosfato, calcio y sílice, a excepción del óxido de bismuto presente en el MTA (16) (18), (22), (23) por lo que se espera que las reacciones también sean similares. (18) Adicionalmente, análisis macroscópico, microscópico y difracción de rayos X, presentan al MTA y al PC como 2 materiales muy similares por sus principales componentes en común: fosfato, calcio y silicio. (22) (79) A pesar que se puede inferir que por el bajo costo del PC y propiedades físicas y mecánicas similares cuando se compara con MTA, es considerable razonar que el mismo puede servir como sustituto del MTA en el área de Endodoncia. Sin embargo; es importante hacer énfasis que ambos materiales no son idénticos. Los componentes del MTA tienen un menor tamaño de la partícula, contienen menos metales pesados tóxicos, posee un mayor tiempo de trabajo y parece haber sufrido un proceso adicional de purificación que el PC común. (24), (25) Además, la fabricación industrial del PC no está aprobada actualmente para su utilización en los Estados Unidos, y por lo tanto no se puede recomendar su uso clínico en seres humanos. Se deben llevar a cabo estudios in Vitro e in Vivo, especialmente en cuanto a su biocompatibilidad, para determinar si cumple con los requisitos establecidos por la Federación Dental Americana (FDA) para su uso como material odontológico. (25) No obstante, existen diferentes estudios que han evaluado las propiedades físicas, químicas y biológicas del MTA y del PC para tratar de determinar las posibles similitudes desde todos los puntos de vista, para que en un futuro el PC pueda ser utilizado en la práctica endodóntica como sustituto o una alternativa al MTA. En este sentido, dentro de las propiedades físicas y químicas, el pH del MTA es de 12,5, permaneciendo estable después de su gelificación (4), mientras que el pH del PC aumenta considerablemente durante el primer minuto después de su hidratación, alcanza el valor de 12.3 y continúa aumentando hasta un valor máximo de 12.9 después de 3 horas. (26) El MTA al contener entre sus componentes el óxido de bismuto, le confiere la propiedad de ser más radiopaco que la dentina (4) Al contrario de PC que en su estado natural es ligeramente radiopaco, pero no cumple con el requisito mínimo de radiopacidad establecido en la norma ISO 6876: 2001, siendo ésta una desventaja importante en caso de ser utilizado clínicamente. (24), (25), (29) El MTA posee aproximadamente la mitad del contenido de sulfato de calcio que contiene el PC, así como también pequeñas cantidades de aluminio, que le proporciona un mayor tiempo de endurecimiento que al PC (24), siendo el sulfato de calcio un elemento importante en el tiempo de endurecimiento. (21) El tiempo de endurecimiento del MTA es de 2 horas 45 minutos (+ 5 minutos). (4) lo prolongado de este tiempo se ha considerado como una desventaja, diferentes estudios han utilizado aceleradores como el cloruro de calcio y fosfato dibásido de sodio para reducir este tiempo. (24), (27), (31) El uso de una menor concentración o de menores cantidades de los aceleradores podría ofrecer la ventaja de producir un menor cambio en las propiedades físicas del MTA y PC y un tiempo de endurecimiento más lento. Un ajuste del tiempo menor a los 10 minutos como se reportó en un estudio (27), podía ser demasiado rápido para determinados procedimientos tales como la colocación de una barrera apical. Por otro lado, un tiempo de endurecimiento más rápido, podría ser conveniente para el sellado de perforaciones y obturación del extremo apical. Los resultados de otro estudio sin la adición de aceleradores, demostraron que el tiempo de endurecimiento del ProRoot® MTA gris (Dentsply Tulsa Dental, Tulsa, OK) fue similar al del PC común (Asia Cements Pte. Ltd., Singapore); mientras que el del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK) fue similar al del PC blanco (Asia Cements Pte. Ltd.) Esto sugiere que el MTA blanco puede contener al PC blanco como material de base. (25) Si bien el prolongado tiempo de endurecimiento del MTA le impide ser utilizado como material de protección temporal, se ha sugerido que el PC con la adición de aceleradores, puede ser empleado como material de restauración. (24), (25), (29) Adicionalmente, el efecto de mezclar el polvo del MTA con diferentes líquidos y aditivos ha demostrado que la preparación puede tener efecto sobre el tiempo de endurecimiento y la fuerza compresiva del material. El clínico puede considerar diferentes soluciones en lugar de agua estéril, sin embargo, debe tener en cuenta el potencial terapéutico y la ganancia o pérdida de las propiedades físicas del material. (32), (33) Igualmente, la cantidad de agua destilada utilizada para la reacción de hidratación del MTA o del PC puede influir sobre sus propiedades químicas, físicas y biológicas. (34), (38) La utilización de un líquido o de una solución con menor tensión superficial, además de proporcionar una mejor acción humectante, también proporcionará una mejor plasticidad, mejorando las condiciones de trabajo. Aunque también puede causar alteración en el tiempo de gelificación. (34) La reacción que se produce durante la hidratación de los cementos de MTA y PC es exotérmica, y el aumento de la tasa de hidratación puede aumentar la tasa de generación de calor. La adición de aceleradores puede también aumentar el calor liberado por la reacción. (36) De acuerdo con el fabricante del ProRoot® MTA (Dentsply Tulsa Dental, Tulsa, OK) la solubilidad del material en agua está comprendida entre 0,1% y 1,0%, considerándose ligeramente soluble. (12) Según Material Safety Data Sheet (MSDS) de industrias productoras del PC, este material presenta una solubilidad comprendida entre 0,1% y 1,0%, lo que evidencia la similitud de solubilidad entre ambos materiales. (34) Aunque, algunos estudios han reportado que el MTA no muestra ninguna solubilidad (4), (14) Fridland y Rosado (38) demostraron que la solubilidad aumenta de manera significativa cuando se incrementa la proporción de agua polvo en el ProRoot® MTA. El MTA (Loma Linda University, Loma Linda, CA, USA) es el precursor del ProRoot MTA® y no fue fabricado por la Dentsply Tulsa Dental. Es posible que una modificación en el proceso de fabricación sea la causa de la diferencia de solubilidad. (38) Es por ello, que el ProRoot® MTA debe utilizarse según las indicaciones del fabricante para asegurarse que la solubilidad del cemento se mantenga al mínimo. Algunos estudios in Vitro han evaluado la resistencia compresiva del MTA y del PC (4) (39), (41). Los mismos han reportado resultados ventajosos con el uso del MTA, estando directamente relacionados con los principios mecánicos de retención cavitaria y no específicamente con las propiedades adhesivas del material. Se ha encontrado una disminución de la resistencia mecánica del PC cuando aumenta el contenido de óxido de bismuto y además se ha observado un incremento en la porosidad material. Al aumentar la porosidad del material, se incrementa la solubilidad, y por lo tanto la desintegración del mismo. Este hecho, podría afectar potencialmente la longevidad del material y por ende la capacidad de sellado, en comparación con la del PC puro. (40) El uso del MTA mezclado con gluconato de clorhexidina al 2% sólo puede ser recomendado en zonas expuestas a un mínimo de fuerza compresiva, hasta que no se presenten pruebas que garanticen que la CHX no ejerce un efecto biológico negativo sobre los tejidos circundantes. (41) El estudio de la microfiltración del MTA y otros materiales endodónticos, constituye un aspecto crítico a evaluar, ya que la humedad puede ser un factor importante debido a su efecto sobre las propiedades físicas y la calidad del sellado de los materiales restauradores. (43) La literatura existente en general, ofrece muchas variaciones en los resultados obtenidos en los estudios de sellado marginal, debido a las limitaciones inherentes de los estudios de filtración por tinción y de radioisótopos y a la ausencia de correlación entre la filtración bacteriana y a las moléculas de tinción y de isótopos, los estudios de filtración bacteriana han sido recomendados para medir el potencial de los materiales de obturación. (57) Sin embargo cuando el MTA es comparado con otros materiales como lo es la amalgama, IRM®, iónomero de vidrio y SuperEBA®, Los resultados arrojan que la filtración del MTA es significativamente menor con respecto a los otros materiales, cuando es utilizado como obturación del extremo apical después de la resección apical (2), (3), (43), (45) La capacidad de sellado que muestra el MTA probablemente se debe a su naturaleza hidrofílica y a la leve expansión cuando es manipulado en un ambiente húmedo. (35) También se han reportado estudios comparativos de la capacidad de sellado entre el MTA y el PC, demostrando que no existen diferencias estadísticamente significativas entre ambos, comportándose de forma similar. (52) Asimismo, se ha señalado que no existen diferencias estadísticamente significativas en cuanto a la capacidad de sellado entre el MTA blanco y gris cuando son empleados como materiales de obturación del extremo apical (53), (54) aún cuando es utilizado un vehículo diferente para la mezcla como la CHX. (55) Del mismo modo, estudios de filtración bacteriana han demostrado que el MTA cuando es utilizado como material de obturación del extremo apical, presenta menores íncides de filtración en comparación con la amalgama, SuperEBA® e IRM®. (42), (58) Debido al predominio de microorganismos anaerobios en las infecciones de origen endodóntico, el uso de un modelo de filtración anaerobia es clínicamente relevante. En este sentido, ha mostrado ser eficaz contra el Fusobacterium nucleatum. (59), (60) El PC que parece tener una composición similar al MTA, en un estudio fue el segundo material que demostró la mayor microfiltración bacteriana en contraste con el SuperEBA® y el ProRoot® MTA, que fueron los materiales que presentaron la menor microfiltración. (61) En resumen, el MTA ha sido estudiado utilizando métodos de tinta, filtración de fluidos y métodos de filtración bacteriana. La mayoría de los estudios basados en los métodos de tinta y de filtración de fluidos, muestran que este material en general, permite menor microfiltración que los materiales tradicionales cuando es utilizado como material de obturación apical. Asimismo, cuando se utilizan métodos de filtración bacteriana, muestra ser un material de sellado eficaz en el tratamiento de las perforaciones, como material de obturación del extremo apical y en el tratamiento de ápices inmaduros. (33) Sin embargo, se deben evaluar también otros parámetros a la hora de elegir un material de sellado apical adecuado como la biocompatibilidad, el grado de citotoxicidad y la inducción a la cicatrización y reparación de los tejidos perirradiculares. (61) El material ideal de obturación debe proporcionar un adecuado sellado apical, ser estable dimensionalmente, ser radiopaco, no reabsorbible, no tóxico y ser tolerado por los tejidos periapicales. Además debería ser bactericida o bacteriostático. (9) Algunos estudios han demostrado el potencial antimicrobiano del MTA (62), (63), (42); y del PC (22). Esa actividad se evidencia por el elevado pH alcalino y por la concentración de iones hidroxilo. No obstante la actividad antimicrobiana del MTA es inferior a la del hidróxido de calcio, probablemente en razón de la disminución de la difusión iónica de los productos hidratados con el transcurso del tiempo. No obstante, Flores et al citado por Quintana et al. (64) en un estudio preliminar del PC ordinario, determinaron el crecimiento bacteriano y el pH de este material. Ellos determinaron que este cemento no favorece el crecimiento bacteriano, lo que se explica por su alta alcalinidad (pH de 10), por lo que no provee las condiciones óptimas para la proliferación bacteriana. Por otra parte, otro estudio evaluó las propiedades antimicrobianas del ProRoot® MTA blanco (Dentsply Tulsa Dental, Tulsa, OK) y encontró que éste inhibía el crecimiento del Enterococcus faecalis y el Streptococcus sanguis, y al mezclarlo con CHX al 0,12% en lugar de agua estéril, aumentaba su acción antibacteriana. (66) Asimismo, trabajos publicados por otros investigadores han mostrado que el MTA retarda o impide el crecimiento del Enterococcus faecalis, teniendo una mayor actividad antibacteriana que otros materiales. (9), (63), (67), (68) (69), mencionando que existe una correlación directa entre la concentración del MTA, ya sea de color gris o blanco, y su efecto antibacteriano. (69) Por otro lado, otros trabajos de investigación han evaluado la actividad antifúngica del ProRoot® MTA gris y blanco (Dentsply Tulsa Dental, Tulsa, OK) sobre la Candida Albicans. (9), (22), (70), (71), (72) Cuando ambas presentaciones fueron comparadas, las concentraciones de 50 mg/ml y 25 mg/ml mostraron actividad antifúngica por períodos de hasta una semana. Sin embargo, el MTA gris en concentraciones más bajas, sigue siendo efectivo, mientras que concentraciones similares o inferiores del MTA blanco no muestra ser tan efectivo en la inhibición de la Cándida albicans, cuando es comparado con el MTA gris. (71) , (72) Diversos estudios han demostrado que el MTA es más biocompatible, menos citotóxico y no es mutagénico al ser comparado con otros materiales utilizados de aplicaciones clínicas similares como la amalgama, gutapercha, cemento de óxido de zinc y eugenol, cemento de óxido de zinc mejorado, hidróxido de calcio, ionómero de vidrio, entro otros. (7), (73), (74), (75), (78), (81) En un estudio citomorfológico en presencia de osteoblastos humanos, mostraron que el MTA estimulaba la producción de citocinas y permitía la adherencia de las células al material. Exámenes de microscopía electrónica de barrido revelaron células sanas en contacto con el MTA en períodos de 1 y 3 días, además de la presencia de elevados niveles de interleucina y de osteocalcina. (77) La participación del MTA en la estimulación de la respuesta celular, según Koh et al. (76) se debe a la fase de fosfato de calcio. Esta fase parece causar un cambio en el comportamiento celular, estimulando la adherencia de los osteoblastos al MTA. La capacidad de sellado, la biocompatibilidad y la actividad dentinogénica del MTA es atribuible a estas reacciones físico-químicas. (21) Diversos trabajos han mostrado que el MTA y el PC presentan propiedades biológicas similares. En opinión de los autores, a pesar de la ligera diferencia en sus composiciones, ambos materiales no son citotóxicos y a consecuencia de ello, permiten la adhesión celular, promoviendo la formación de hueso. (79), (86) En base a lo anterior, se cuestiona de cómo este mismo fenómeno es producido por el MTA y PC, ya que ambos no presentan en su composición hidróxido de calcio. (82) Torabinejad et al. (4) señalan que el MTA muestra fases específicas en todo el material después de la reacción con el agua. Estos mismos autores refieren que el MTA está constituido por sulfato de calcio y fosfato de calcio. Aunque no presenta entre sus componente hidróxido de calcio, el sulfato de calcio reacciona con los fluidos de los tejidos para formar hidróxido de calcio. No esta aún dilucidado si esto mismo ocurre con el PC, pero los resultados similares entre ambos materiales sugieren la posibilidad de que esto ocurra. El resultado de otras investigaciones confirman el resultado de éste estudio, donde sugieren que el MTA y PC son materiales similares. (22), (79), (82), (83) Por ser el óxido de calcio uno de los componentes del MTA, estaría teóricamente explicada la reacción tisular de este material con la del hidróxido de calcio. Se ha observado, la formación de una capa de cemento sobre el MTA, cuando es utilizado como material de obturación del extremo apical. (34) (75), (92), (93), (94) También se han estudiado las posibles diferencias biológicas entre el MTA gris y blanco, indicando que el mecanismo de acción de ambas presentaciones es similar, descartando así diferencias entre ellos. (84) Sin embargo, en un estudio realizado por Perez et al. (85) demostró que las células osteoblásticas en contacto con el MTA gris tenían una mayor y mejor capacidad de adherirse y diferenciarse que aquellas que se encontraron en contacto con el MTA blanco, refiriendo que éste último no era tan biocompatible como la forma gris y refieren que la diferencia podría deberse a la morfología superficial de ambos materiales. Es opinión de los autores, que aunque no se puede tomar una relevancia clínica inmediata de estos estudios in Vitro, es importante para el clínico notar que las características de estas 2 presentaciones difieren suficientemente para provocar diferentes respuestas celulares. La importancia de estas diferencias en un ambiente clínico debe ser establecida por estudios in Vivo a profundidad. (85) Los resultados positivos del estudio realizado por De Deus et al. (88), donde también evaluaron las propiedades biológicas del PC, resultan alentadoras para su como un material restaurador en Endodoncia, pero se necesitan de más estudios antes de que sea justificado su uso clínico. Sin embargo, otro aspecto a considerar, es que se ha cuestionado el uso del PC en seres humanos, por contener sustancias contaminantes. En particular, existen inquietudes en relación con la presencia de arsénico en el PC. Los resultados han demostrado niveles muy bajos de arsénico liberado, lo que demuestra que no hay contraindicación para el uso del PC en la práctica clínica, en la medida de lo que al contenido de arsénico se refiere. (89) Diferentes materiales se han utilizado para el sellado de las perforaciones, pero no cumplen con las propiedades ideales que deberían tener como lo son la capacidad de sellado, ser biocompatible y capacidad de inducir la osteogénesis y cementogénesis. (39) Sin embargo, el MTA si presenta estas propiedades. Ha sido investigado como potencial sellador de las vías de comunicación entre el sistema de conductos radiculares y la superficie externa del diente; por lo tanto es un material adecuado para el tratamiento de las perforaciones, cumpliendo con el objetivo de lograr la regeneración periodontal e inducir la osteogénesis y cementogénesis. (1), (42), (77), (92), (101), (102), (103) Las perforaciones de larga data con inflamación periodontal pueden ser tratadas con éxito con MTA y el control de la infección en el conducto radicular y en el sitio de la perforación es necesario para el sellado satisfactorio de la perforación y para la cicatrización. El uso de una matriz de colágeno, promueve la cicatrización del ligamento periodontal, como se muestra en los casos. Sin embargo, son necesarios más estudios clínicos para investigar la previsibilidad de los resultados de la técnica. (106) Adicionalmente, el sellado de perforaciones como consecuencia de una resorción interna puede lograrse por vía intracoronaria o por vía quirúrgica, constituyendo así el MTA el material indicado para dicho fin. (5), (109), (101), (110) Hasta el momento se han propuesto múltiples materiales de obturación del extremo apical, hasta ahora ninguno de estos materiales ha demostrado predeciblemente la regeneración del periodonto a todo lo largo de la superficie radicular. (81) Recientemente el MTA se ha sugerido como un material para la obturación del extremo apical. (4), (6), (43), (57), (75), (77), (81), (111) Ya que experimentalmente se ha observado aposición de cemento sobre la superficie resecada y el material de obturación apical. (43), (75), (113) El uso de MTA como material de obturación del extremo apical y técnicas microquirúrgicas, demustran una alta tasa de éxito. (115) También el MTA ha sido empleado como barrera apical para la inducción al cierre como alternativa al hidróxido de calcio, ya que el problema más importante que se presenta con la apicoformación mediante el uso del hidróxido de calcio es la duración de la terapia, que va de 3 a 21 meses. (118) El MTA induce la formación de tejido duro (6) demostrando que cuando se utiliza como barrera apical en dientes necróticos con ápices inmaduros, el conducto puede ser perfectamente sellado (120), (122) La reparación de las exposiciones pulpares no dependen sólo del material de recubrimiento, pero sí está relacionado con la capacidad de estos materiales para evitar la filtración bacteriana, y por otro lado también depende de las condiciones de asepsia en las que se realiza este tipo de procedimiento. (5) Debido a que el MTA ha demostrado que previene la filtración bacteriana (3), (43), (9), (63), (67), (68) (69), además de tener un alto nivel de biocompatibilidad (7), ( 73), (74), (75), (78), (81), ha resultado un material exitoso en el tratamiento de pulpas vitales como recubridor pulpar diercto, mostrando un comportamiento superior al hidróxido de calcio. La dentinogénesis del MTA puede ser debida a su capacidad de sellado, biocompatibilidad, alcalinidad y posiblemente a otras propiedades asociadas a este material. (74), (77), (128) Con el uso del MTA los tejidos cicatrizan de una manera más rápida que con la pasta de hidróxido de calcio, aunque después de los 60 días, ambos materiales demuestran resultados exitosos en el recubrimiento pulpar de dientes humanos. (133) Asimismo, el MTA ha mostrado resultados satisfactorios cuando es utilizado en procedimientos de pulpotomías vitales tanto en dientes temporales como en dientes jóvenes permanentes, ya que bajo condiciones óptimas, éste material tiene la capacidad de formar tejido duro e inducir la formación radicular. (134), (135) Además, también ha sido indicado como material base posterior al tratamiento de conducto, y antes del blanqueamiento intracoronario, como material de obturación provisional y para restaurar fracturas verticales. (5)
IV.- CONCLUSIONES 1. Existen una gran cantidad de materiales odontológicos, todos ellos deben cumplir con una serie de requisitos para su aprobación, como lo son ser no tóxico, no mutagénico, producir un adecuado sellado, estable dimesionalmente, ser bien tolerado por los tejidos perirradiculares, bactariostático, no reabsorbible, radiopaco, y promover la cicatrización tisular. Sin embargo todavía no existe el material que se considere como ideal 2. Surge así en el mercado odontológico el Agregado de Trióxido Mineral (MTA) que si cumple con la mayoría de las propiedades que debería poseer un material ideal, presentando éste una excelente capacidad de sellado, adaptación marginal, capacidad para formar puentes de tejido duro, biocompatible, pH alcalino, no favorece la inflamación e induce la aposición ósea y de cemento 3. Actualmente, existen varias marcas comerciales de MTA, en 2 presentaciones blanco y gris. Todas ellas se derivan de la fórmula original del MTA (Loma Linda University, Loma Linda CA). Los componentes de la formulación gris son similares al blanco. La principal diferencia con ésta presentación es la disminución del componente de hierro, el cual es el responsable de la variación en el color 4. No hay diferencias estadísticamente significativas en cuanto a las propiedades físicas y químicas de ambas presentaciones, sin embargo, el MTA gris tiene mejor capacidad de adhesión y diferenciación celular, haciéndolo más biocompatible que el blanco. Éste último no contiene las grandes partículas del MTA gris, que son importantes para el manejo de las propiedades clínicas 5. Recientemente se ha sugerido que existe un material con características físicas, químicas y biológicas muy similares al MTA; el Cemento de Portland (PC), un cemento de uso común en la industria de la construcción. Los componentes químicos del PC constituyen el 75% de los elementos presentes en el MTA, siendo la única diferencia la ausencia del óxido de bismuto, el cual se le adiciona al MTA para conferirle la radiopacidad 6. Hay que mantener presente que el MTA y el PC no son iguales. Los componentes del MTA tienen un menor tamaño de la partícula, contiene menos metales pesados tóxicos, posee un mayor tiempo de trabajo y parece haber sufrido un proceso adicional de purificación que el PC 7. El MTA y el PC son materiales altamente alcalinos, esta propiedad les permite no crear condiciones óptimas para la proliferación bacteriana. Otra propiedad importante es la radiopacidad, el MTA a diferencia del PC es más radiopaco que la dentina. La ligera radiopacidad del PC es una desventaja es caso de ser utilizado clínicamente, ya que nos impide la realización de los controles y seguimientos postoperatorios de los casos clínicos 8. La presencia del sulfato de calcio es el responsable del endurecimiento del material. Éste se encuentra presente en el MTA, lo cual hace que tenga un tiempo prolongado de endurecimeinto, conviertiendose en una desventaja para éste. Mientras que, el PC contiene la mitad del contenido de éste compuesto. La adición de aceleradores para disminuir este tiempo podría ser contraproducente en determinados procedimientos clínicos 9. El MTA y el PC son insolubles, sin embargo, cuando se producen cambios en las proporciones polvo-líquido, pueden ocurrir cambios en las propiedades físicas de los materiales 10. Los resultados ventajosos tanto para el MTA como el PC, con respecto a la resistencia al desplazamiento y a la tracción, están directamente relacionados con los principios mecánicos de retención cavitaria y no específicamente con las propiedades adhesivas de cada material 11. En términos de capacidad de sellado y microfiltración marginal en estudios de tinción, tanto el MTA como el PC se comportan de forma similar, mostrando resultados satisfactorios 12. Los estudios de biocompatibilidad y de filtración bacteriana donde se evaluaron los efectos antimicrobianos del MTA y PC, han demostrado que ambos actúan sobre bacterias anaerobias facultativas, teniendo su efecto nulo, sobre las bacterias anaerobias estrictas 13. Existe una relación directa entre la concentración del MTA y su acción antibacteriana y antifúngica, requiriendo la presentación gris de menores concentraciones para ejercer el mismo efecto sobre los microorganismos cuando se le compara con el MTA blanco. Cuando se mezcla gluconato de clorhexidina al 0,12% en lugar de solución salina estéril con MTA aumenta su acción antibacteriana 14. El MTA y el PC, a pesar de la pequeña diferencia en su composición, ambos permiten la adhesión celular y promueven la formación ósea, no considerándose materiales mutagénicos. Igualmente, los niveles de arsénico presentes en el MTA y el PC son mínimos, no teniendo contraindicaciones para su uso clínico, en lo que se refiere al contenido de este contaminante 15. Existen varios tipos de PC, pero no está permitido su utilización en seres humanos, porque envuelve principios éticos y jurídicos 16. El MTA se considera un material adecuado para el sellado de las perforaciones ya que brinda una excelente capacidad de sellado, es biocompatible y posee la capacidad de inducir la osteogénesis y la cementogénesis 17. El MTA también puede ser utilizado como material de obturación del extremo apical ya que en la mayoría de los estudios se ha evidenciado la aposición de cemento sobre la superficie resecada y sobre el material, favoreciendo la regeneración del ligamento periodontal 18. En dientes necróticos con ápices abiertos el MTA promueve la formación de una barrera calcificada durante el proceso de apicoformación. El empleo de este material brinda procedimientos más cortos, ya que es posible realizar tratamientos de conductos en una sóla cita, evitando tratamientos tan prolongados como son las terapias con hidróxido de calcio 19. En el tratamiento de pulpas vitales como el recubrimiento pulpar directo y la pulpotomía vital, el MTA muestra una respuesta favorable, sin embargo, el éxito de estos procedimientos va a depender también de la selección adecuada del caso, es decir, que no hayan signos y síntomas asociados a pulpitis irreversible, tamaño de la exposición, control de la hemorragia y las condiciones de asepsia en las que se realizan los procedimientos
V.- RECOMENDACIONES 1. Se hacen necesarias más investigaciones entre las dos presentaciones de MTA, ya que a pesar de las similitudes encontradas entre sus propiedades físicas y químicas, en términos de biocompatibilidad ha mostrado resultados contradictorios 2. Se recomienda para el manejo de situaciones clínicas donde la estética esté comprometida, la utilización del MTA blanco, ya que previene la pigmentación dental, desventaja que muestra el MTA original 3. Se recomienda que los cementos deben utilizarse según las indicaciones del fabricante para asegurarse que la solubilidad se mantenga al mínimo y evitar la desintegración de los materiales 4. La utilización del PC no está aprobada por la Federación Dental Americana para su utilización en pacientes. Se deben llevar a cabo más estudios, especialmente en cuanto a biocompatibilidad, tiempo de endurecimiento y fuerza compresiva, para determinar si cumple con las normas establecidas para su uso como material odontológico, ya que esto representaría una alternativa por su bajo costo en comparación con el MTA
VI. REFERENCIAS
Invitados Anteriores y sus Trabajos ¿Comentarios? carlosboveda@carlosboveda.com.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||